
����Ŀ��(1)���������������������֣�
��________�������Բ����������ϣ�
��________�������Ա���¶��ѷŲ��������⣻
��_____��������ʹ���������С���ܳ�������ԭ���Լ������������ŵ㡣
(2)��������������Դ���ִ�����ɺ��ӵ���Ҫ�����ٳ����������������õ�һ��������_________��
(3)������������������Ҫ���������з��࣬һȺ����־Ը����ij�����ƹ��������࣬������������������һЩ�з����־�����������䣬���ȴ�������������û�з�����á�������������ԭ�������________��
A.�������鷳��û�����������ϰ�� B.����ÿ��������������dz���
C.����Ļ�����ʶ��ǿ D.���������������ı�
(4)
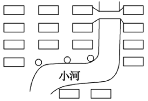
��ͼ��ij����С���������ռ���(СԲȦ)�IJ��֣�����ѡַ�ϴ��ڵ�����������_________��________�������ռ���ѡַӦ���ǵ����ذ���(�������)________��________��________��
���𰸡��ѷ� �������� ���� ��������ȡȼ����(���ֽ�����������츴�ϰ壻�ϲ���ƿ���첣��˿�ȣ����������𰸾���) ACD �����ռ���ֲ������� �����ռ����غ����ã���ȾˮԴ(���������𰸾���) �Ƿ���ھ���Ͷ������ �Ƿ�Ӱ���������� �Ƿ�Ӱ��������ľ���[�Ƿ�����ٴ���
Ⱦ���Ƿ�����������������(��ѡ3�㣬���������𰸾���)]
��������
�������ϲ������漰ǧ������Ҫ���ϴ����������ķ���������������á����������ա�Ϊ�˻���������������������������ռ������䡢�����ۺϿ��ǣ����ڴﵽ�������á�����������Ŀ�ġ�
(1)���������������������֣�
�ٱ������������������ȣ����Բ����������ϣ���������Ϊ�ѷʷ�����Ϊ���ѷʣ�
�ڱ��罨������������ռ�ض࣬Ӧ����¶��ѷţ���������Ϊ����������Ϊ����������
����������к��н϶����Ҷ����֦����ݣ���ʹ���������С������������ԭ���Լ����ò����������ȣ���������Ϊ���շ�����Ϊ�����գ�
(2)���������������õ�����Ϊ����������ȡȼ����(���ֽ�����������츴�ϰ壻�ϲ���ƿ���첣��˿�ȣ����������𰸾���)����Ϊ����������ȡȼ����(���ֽ�����������츴�ϰ壻�ϲ���ƿ���첣��˿�ȣ����������𰸾���)��
(3)�������û�н�����������ã�������������ԭ������Ǿ������鷳��û�����������ϰ�ߡ�����ÿ��������������dz��ࡢ���������������ı��ȡ���Ϊ��ACD��
(4)ͼ�������ռ�����ּ��У�����Щ����Һ�Զ���ҿ���ˮԴ������ѡַ�ϴ��ڵ����������������ռ���ֲ������Ⱥ������ռ����غ����ã���ȾˮԴ(���������𰸾���)�������ռ���ѡַӦ���ǵ����ذ���(�������)���Ƿ���ھ���Ͷ���������Ƿ�Ӱ����������Ƿ�Ӱ��������ľ���[�Ƿ�����ٴ���Ⱦ���Ƿ�����������������(��ѡ3�㣬���������𰸾���)]����Ϊ�������ռ���ֲ������ȣ������ռ����غ����ã���ȾˮԴ(���������𰸾���)���Ƿ���ھ���Ͷ���������Ƿ�Ӱ����������Ƿ�Ӱ��������ľ���[�Ƿ�����ٴ���Ⱦ���Ƿ�����������������(��ѡ3�㣬���������𰸾���)]��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����SO2ʵ�鷽���������»�ѧʵ�顣
��.ʵ�鷽��һ
(1)��SO2ͨ��ˮ���γɡ�SO2������H2SO3��Һ����ϵ������ϵ�д��ڶ������Ԫ�ص�ƽ�⣬д������1��ƽ�ⷽ��ʽ��________________________________________��
(2)��֪�����Ѿ���������SO2��������������[�ҹ����ұ�(GB2760��2014)�涨���Ѿ���SO2�IJ�������0.25 g��L��1]��
����SO2��Ư���Լ��ɰ����Ѿ�(Һ��Ϊ��ɫ)�е�SO2��H2SO3�������ͼ1��ʵ�飺
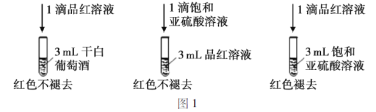
ʵ����ۣ��ɰ����ѾƲ���ʹƷ����Һ��ɫ��ԭ��Ϊ��_____________��
��.ʵ�鷽����
��ͼ2��ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������
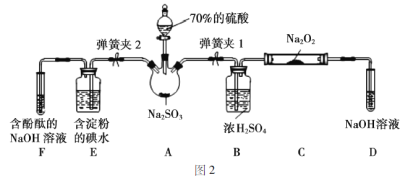
(1)�رյ��ɼ�2�����ɼ�1��ע����������û������ƿ�й��壬����SO2��Na2O2��Ӧ�Ƿ����������ɵķ�����_________________________��
(2)װ��D��ʢ��NaOH��Һ��������______________________��
(3)�رյ��ɼ�1���ɼ�2�������������E��F�У���˵��I����ԭ������SO2������Ϊ_____________��������Ӧ�����ӷ���ʽ��______________��
��.ʵ�鷽����
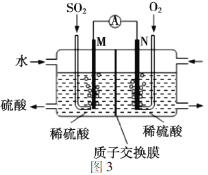
�õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ��ͼ3װ��(�缫��Ϊ���Բ���)����ʵ�飬�������Ʊ����ᣬͬʱ��õ��ܡ�M�������ĵ缫��ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ķ��ӽṹ�ɼ�д�ɼ���ʽ�ṹ![]() ���л���A�ļ���ʽ�ṹΪ
���л���A�ļ���ʽ�ṹΪ![]() ���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�������й�˵��������ǣ�������
���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�������й�˵��������ǣ�������
A. ��ϵͳ�����������л���A������Ϊ2��2��3����������
B. �л���A��һ��ȡ����ֻ��4��
C. �л���A�ķ���ʽΪC8H18
D. B�Ľṹ������3�֣�����һ������Ϊ3��4��4��������2����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ���Ϊ���ĵ���ؼ��㣬��֪�����ӵ�����ΪNA��
��1��������ͬ��H2��NH3��SO2��O3���������У����з�����Ŀ���ٵ���_________������ͬ�¶Ⱥ���ͬѹǿ�����£����������___________��
��2��73.0g HCl�����к���_______�����ӡ�______�����ӡ�
��3��23.75 gij��2�۽������Ȼ��MCl2���к���3.01��1023��Cl������MCl2��Ħ������Ϊ______�� M�����ԭ������Ϊ________��
��4����0.5L1mol/L FeCl3��Һ��ˮϡ����1L,������Һ�������ӵ����ʵ���Ũ����_____��
��5��3.01��1023��CO2�ڱ�״���µ����ԼΪ______L������_____g CO������ͬ����ԭ������
��6���ڱ�״����22.4 L�ɵ�����������ɵĻ�����壬������Ϊ30g������������������Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������봦��������Ӧ�ķ�Ӧ����ʽ����ȷ����
A.����ˮ��Ͷ������������������������Ľ��壺Al3����3H2O![]() Al(OH)3(����)��3H��
Al(OH)3(����)��3H��
B.�ø��´�������ȥ���������(CxHy)��CxHy��(x��y/4)O2![]() xCO2��y/2H2O
xCO2��y/2H2O
C.�ô�����������β���е�CO��NO��CO��NO![]() C��NO2
C��NO2
D.��Na2S�γɳ���ȥ����ˮ�е�Hg2����Hg2����S2����HgS��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к��зḻ�ĵ����ʡ�֬����Ӫ�����ʣ��ɴӹ�������ʳƷ�ܶ࣬��������ϲ������ش��������⣺
(1)�������ԵĶ�������Ҫ�ɷ���________(��д��ĸ)��
A.���� B.������ C.֬�� D.����
(2)�㶹�������õ����ۼ���________(��д��ĸ)��
A.ʯ�� B.���ᱵ C.�������� D.����
(3)����ʳ�õĴ����ղ�����������Ҫ�ɷ���________(��д��ĸ)��
A.������ B.������ C.���� D.����
(4)���к���һ���������ࡣ��Һ̬�����ˮ������DZ�����(�׳�________)��________������ӽṹ��________(��С����ޡ�)̼̼˫�����������Ľṹ��ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ģ�������ã����õ��CO2��H2O�ķ����Ʊ�CH3CH2OH��O2װ����ͼ��ʾ������˵������ȷ����
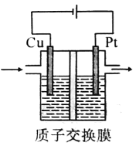
A. ����Ϊ����������������Ӧ
B. �������У�H+�ɽ���Ĥ������Ҳ�Ǩ��
C. �����ĵ缫��ӦʽΪ2CO2+12H++12e��====CH3CH2OH+3H2O
D. ��·��ת��2mol����ʱ��������11.2LO2����״����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ؼ��仯����������������кܶ���Ҫ��;��
��±�ػ�ѧ�ḻ��ʣ����γ�±���±�ػ������±����ȶ������͵Ļ����
��1����±����(CN)2��(SCN)2��(OCN)2 ����±�ص��ʽṹ���ơ������������֪(CN)2����������ԭ�Ӷ����� 8 �����ȶ��ṹ����������� �� ���� �� ����Ŀ֮��Ϊ_______��(SCN)2��Ӧ���������֣������������ᣨH��S��C��N ���ķе�����������ᣨH��N=C=S���ķе㣬��ԭ����_____________��
��2��±���� RbICl2 �ڼ���ʱ��ֽ�Ϊ��������Խϴ��±���� A ��±�ػ������±�ص��ʣ�A �Ļ�ѧʽ_____________��
��SiC��GaN��GaP��GaAs �����˹��ϳɰ뵼��IJ��ϣ� ���и��¡���Ƶ�����ʺͿ������Ӧ�����ܶ���Ϊ�뵼�������о��ȵ㣮�Իش��������⣺
��3��̼�Ļ�̬ԭ�� L ����ӹ������ʽΪ_______��������_________��Ԫ�أ�
��4��N ����Ԫ�ؿ��γ�һ��ԭ�Ӹ�����Ϊ 1��1 �����ӣ���ʽ��Ϊ 60�����ⶨ����������һ�������幹�ͣ��жϸ������д��ڵĻ�ѧ��_________.
A����λ�� B�����Թ��ۼ� C���Ǽ��Թ��ۼ� D�����
��5��CaC2����ľ����ṹ�� NaCl ��������ƣ���ͼ1 ��ʾ������ CaC2 �����к��е������� C22���Ĵ��ڣ�ʹ������һ������������ CaC2 ������ 1 �� Ca2+��Χ��������� C22����ĿΪ________��
���� A��B��C Ϊԭ���������ε�����ǰ�����ڵ�Ԫ�أ�A �ĵ�һ�����ܽ���þ������Ԫ��֮�䣬A ���ʾ���ľ����ṹ��ͼ2 ��ʾ�� B�ļ۵����Ų�Ϊ��n+1��sn��n+1��pn+2��Cλ��Ԫ�����ڱ��� ds �������̬ԭ�Ӳ����ڲ��ɶԵ��ӣ� B�� C���γɻ����ᄃ��ľ�����ͼ3 ��ʾ��
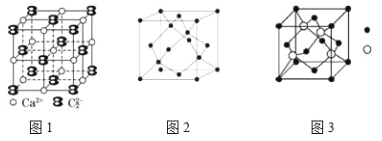
��6��A ���ʾ�������_________���壨������ͣ�.
��7��B �� C ���γɻ����ᄃ��Ļ�ѧʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾʵ��װ��̽��ͭ��Ũ����ķ�Ӧ����¼ʵ��������±���
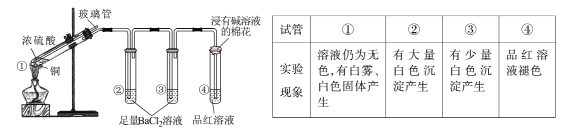
����˵����ȷ����
A.���а�ɫ������BaSO3
B.���п����в�������ӷ���
C.Ϊȷ�����а�ɫ�����Ƿ�Ϊ����ͭ��������ȴ����Թ���ע��ˮ����
D.ʵ��ʱ������װ����ͨ������N2���ټ����Թܢ٣�ʵ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com