
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
【答案】B
【解析】
A.最长的主链含有5个C原子,从距离甲基近的一段编碳号,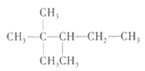 的名称为:2,2,3-三甲基戊烷,选项A正确;
的名称为:2,2,3-三甲基戊烷,选项A正确;
B.根据信息可知,A的结构简式为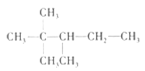 ,分子中有5种化学环境不同的氢原子,故其一氯代物有5种,选项B错误;
,分子中有5种化学环境不同的氢原子,故其一氯代物有5种,选项B错误;
C.由A的结构简式可知,A的分子式为C8H18,选项C正确;
D.A是有机物B与等物质的量的H2发生加成产物,则B中含有1个C=C双键,根据加成反应还原双键,A中相邻碳原子上都含有H原子的可以含有碳碳双键,故B的结构简式可能有如下三种:
 、
、 、
、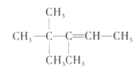 ,它们名称依次为:3,3-二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,选项D正确;
,它们名称依次为:3,3-二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,选项D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问題。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______(填“强电解质”或“弱电解质”),其电离方程式____________________________________。
(2)已知:常温下0.1mol·L-1 BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____性,请用离子方程式解释原因________________。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苦杏仁酸在医药工业可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体,下列路线是合成苦杏仁酸及其衍生物的一种方法:
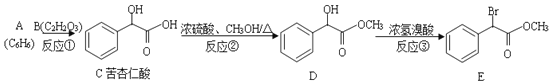
(1)苦杏仁酸中含有的官能团名称__________。
(2)生成C的反应类型_________。B的结构简式____________。
(3)1molE最多可以与___________NaOH反应。
(4)反应③的化学方程式为_______。
(5) 两个C分子可以反应生成具有三个六元环的化合物F,则F的结构简式为______。
(6)写出满足下列条件的C的同分异构体,既能发生银镜反应,又能发生水解反应,遇到FeCl3溶液显紫色,其中苯环上只有两个位于对位取代基,其结构简式为________。
(7)已知:RCH2COOH![]() RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(
RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(![]() )的合成路线______。
)的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L1盐酸滴定10.0 mL浓度为0.1 mol·L1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是
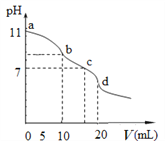
A.Ka2(H2A)的数量级为109
B.当V=5时:c(A2)+c(HA)+c(H2A)=2c(Cl)
C.NaHA溶液中:c(Na+)>c(HA)>c(A2)>c(H2A)
D.c点溶液中:c(Na+)>c(Cl)>c(H+)=c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C. 甲烷可与水形成氢键
D. 白酒中,乙醇分子和水分子间存在范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞属于面心立方最密堆积,晶胞中相邻最近的两个CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是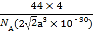 g·cm-3
g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的立体构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
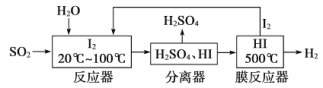
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常用垃圾处理方法有三种:
①________法,可以产生大量肥料;
②________法,可以避免露天堆放产生的问题;
③_____法,可以使垃圾体积缩小,能彻底消灭病原体以及产生热量等优点。
(2)回收利用垃圾资源是现代生活不可忽视的重要活动。请举出生活垃圾回收利用的一个事例:_________。
(3)回收利用垃圾,首先要对垃圾进行分类,一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标志的垃圾回收箱,结果却发现有许多居民并没有分类放置。造成这种现象的原因可能是________。
A.居民嫌麻烦,没有垃圾分类的习惯 B.居民每天产生的垃圾量非常多
C.居民的环保意识不强 D.居民不清楚垃圾分类的标准
(4)
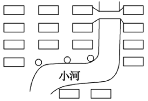
上图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的两个问题是_________和________。垃圾收集点选址应考虑的因素包括(提出三点)________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:

实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com