
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
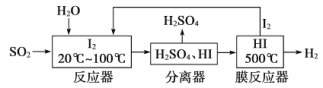
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
【答案】BC
【解析】
从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,在分离器中分离硫酸和HI,在膜反应器中HI发生分解反应产生H2和I2。
A.H2SO4、HI都溶于水,所以分离器中的物质分离操作不可能是过滤,A错误;
B.在反应器中,控制温度为20-100℃,根据温度对化学反应速率的影响,若反应温度过低速率慢,但温度过高,水气化,会使碘单质升华,增大碘的流失,也会导致反应速率比较慢,B正确;
C.在反应器中I2反应转换为HI,在膜反应器中HI分解转化为H2和I2,从而实现了碘循环,C正确;
D.在反应器中发生反应:SO2+I2+2H2O=H2SO4+2HI,在膜反应器中发生反应:2HI=H2+I2,所以碘循环工艺的总反应为2SO2+2H2O=H2+H2SO4,D错误;
故合理选项是BC。


科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
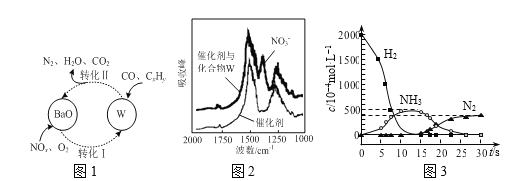
①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞属于面心立方最密堆积,晶胞中相邻最近的两个CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是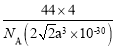 g·cm-3
g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的立体构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
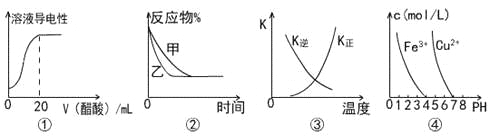
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息:
I2 | 紫黑色晶体,沸点184.3°C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 |
CCl4 | 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 |
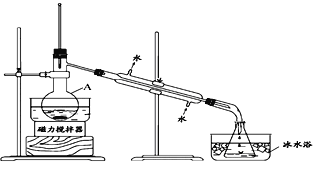
I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验:
(1)该装置中仪器A的名称是____________。
(2)锥形瓶置于冰水中的目的是_____________。
(3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。
①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏
II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验:
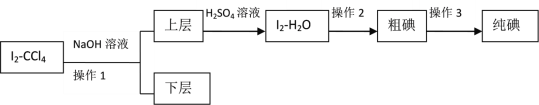
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名称是____________。
(5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。
(6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,![]() 同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.![]() 三种元素形成的化合物中一定只含共价键
三种元素形成的化合物中一定只含共价键
C.由元素![]() 组成的某种化合物可与
组成的某种化合物可与![]() 反应生成
反应生成![]()
D.元素A与![]() 形成的常见化合物中,热稳定性最好的是AD
形成的常见化合物中,热稳定性最好的是AD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com