
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
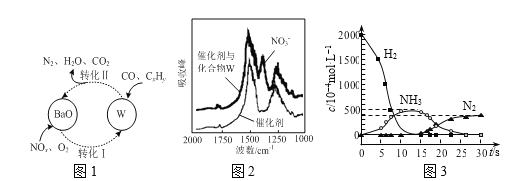
①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
【答案】-1250.3 N2和O2反应为吸热反应,升高温度有利于平衡正向移动 刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢) Ba(NO3)2 0.8mol 8∶1 415NO+4NH3+3O2 415NNO+6H2O
415NNO+6H2O
【解析】
(1) 根据盖斯定律进行计算;
(2)①N2和O2反应为吸热反应,升高温度有利于平衡正向移动;
②刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢);
(3) ①在图1所示的转化中N、O化合价降低,为氧化剂被还原;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba (NO3) 2的N元素化合价由+5价降低到-3价,生成氨气,结合得失电子数目相等计算;
(4)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO由N元素守恒可知15NO与NH3应为1: 1,结合电子得失相等配平。
(1)已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH2=+180 kJ·mol-1
2NO(g) ΔH2=+180 kJ·mol-1
根据盖斯定律,由①-②![]() 2得反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=-1250.3kJ·mol-1;
2得反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=-1250.3kJ·mol-1;
(2)①N2和O2反应为吸热反应,升高温度有利于平衡正向移动,故汽车发动机内的温度越高,生成的NO越多;
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢),排放CO、CxHy、NOn浓度较高;
(3)①在图1所示的转化中N、O化合价降低为氧化剂被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根,再结合图一由钡离子参与,所以X为Ba(NO3)2;
若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,Ba(NO3)2的N元素化合价由+5价降低到0价, 生成氮气,则1molBa(NO3)2生成氮气的过程中得到10mol电子,其中CO转化为CO2的过程中提供2mol电子,即被CO还原的部分是0.2mol,则被CxHy还原的Ba(NO3)2的物质的量为0.8mol;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到- 3价, 生成氨气,则1molBa(NO3)2,生成氨气转移16mol电子,参加反应的氢气的物质的量为![]() = 8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
= 8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
(4)在有氧条件下15NO与NH3以一定比例反应时, 得到的笑气几乎都是15NNO,由N元素守恒可知15N0与NH3应为1 : 1,可知反应的化学方程式为415NO+4NH3+3O2 415NNO+6H2O。
415NNO+6H2O。


科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A.-488.3kJ·mol-1
B.-191kJ·mol-1
C.-476.8kJ·mol-1
D.-1549.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
A.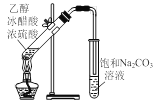 制备乙酸乙酯
制备乙酸乙酯
B.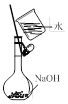 配置一定物质的量浓度的NaOH溶液
配置一定物质的量浓度的NaOH溶液
C.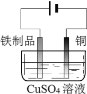 在铁制品表面镀铜
在铁制品表面镀铜
D. 制取少量CO2气体
制取少量CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25 ℃时,NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或 “HCO3-”);
②常温下,0.0100 mol/L盐酸的pH=__________
③用0.0100 mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时, 溶液的颜色由红色变为__________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
①反应达到平衡后,向容器中通入CO,化学平衡向____方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”);
③查阅资料得知1 100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(![]() )中所含的中子数为NA
)中所含的中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验中所选用的实验仪器不能都用到的是
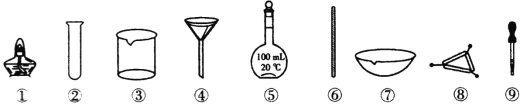
A.除去Na2CO3溶液中的CaCO3,选用③、④和⑥
B.NaC1溶液的蒸发结晶,选用①、⑥和⑦
C.配制100mL 0.1mol·L-1的NaOH溶液,选用③、⑤、⑥和⑨
D.将海带灼烧灰化,选用①、⑦和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
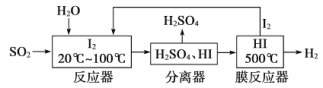
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)![]() 是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
(2)![]() 的键角由大到小的顺序为________________________,
的键角由大到小的顺序为________________________,![]() 的第一电离能由大到小的顺序为_______________________________。
的第一电离能由大到小的顺序为_______________________________。
(3)![]() 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
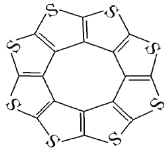
①![]() 分子中
分子中![]() 原子和
原子和![]() 原子的杂化轨道类型分别为_________________________。
原子的杂化轨道类型分别为_________________________。
②测得![]() 中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,![]() 原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将
原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将![]() 原子等同看待,该晶体储氢后的晶胞结构与
原子等同看待,该晶体储氢后的晶胞结构与![]() (如图)相似,该晶体储氢后的化学式为_________________________。
(如图)相似,该晶体储氢后的化学式为_________________________。
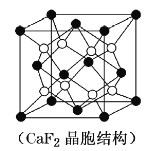
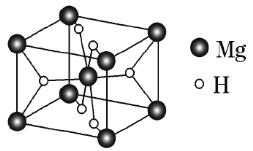
(5)![]() 是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为![]() ,则该晶胞的体积为___________
,则该晶胞的体积为___________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com