
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(![]() )中所含的中子数为NA
)中所含的中子数为NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)=________。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2=2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为_____。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解),纵坐标中A点的数值是________。
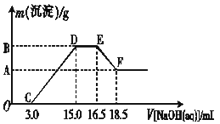
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为__________________。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为___g(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
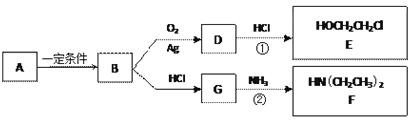
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)

(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
A.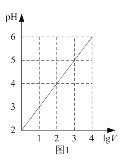 图1表示1 LpH=2的某一元酸加水稀释至V L,pH随lgV的变化,说明该酸是弱酸
图1表示1 LpH=2的某一元酸加水稀释至V L,pH随lgV的变化,说明该酸是弱酸
B.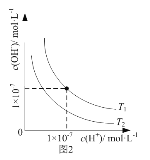 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,说明图中温度T2>T1
图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,说明图中温度T2>T1
C.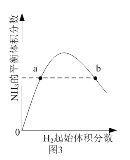 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,说明图中a点N2的转化率小于b点
图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,说明图中a点N2的转化率小于b点
D.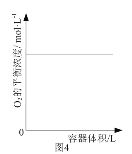 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g), O2的平衡浓度与容器容积的关系,说明改变压强平衡不发生移动
2BaO(s)+O2(g), O2的平衡浓度与容器容积的关系,说明改变压强平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
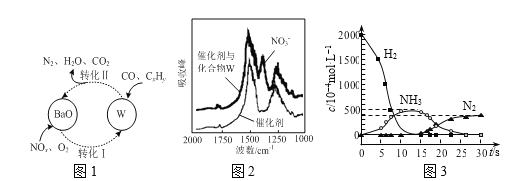
①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞属于面心立方最密堆积,晶胞中相邻最近的两个CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是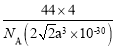 g·cm-3
g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的立体构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
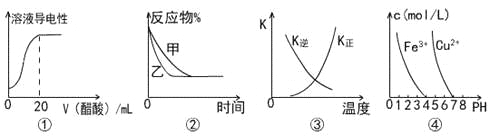
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
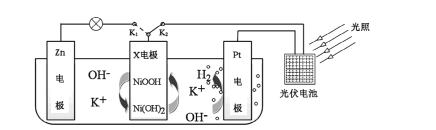
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为![]()
C.供电时,Zn电极附近溶液的pH降低
D.供电时,装置中的总反应为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com