
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
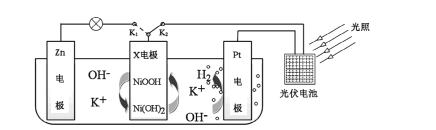
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为![]()
C.供电时,Zn电极附近溶液的pH降低
D.供电时,装置中的总反应为![]()
【答案】D
【解析】
闭合K2、断开K1时,该装置为电解池,Pt电极生成氢气,则Pt电极为阴极,X电极为阳极;断开K2、闭合K1时,该装置为原电池,Zn电极生成Zn2+,为负极,X电极为正极。
A. 制氢时,Pt电极为阴极,电解池中阳离子流向阴极,故A正确;
B. 制氢时,X电极为阳极,失电子发生氧化反应,根据根据化合价可知该过程中Ni(OH)2转化为NiOOH,电极方程式为![]() ,故B正确;
,故B正确;
C. 供电时,Zn电极为负极,原电池中阴离子流向负极,所以氢氧根流向Zn电极,电极反应为Zn-2e-+4OH-=ZnO22-+2H2O,转移两个电子同时迁移两个OH-,但会消耗4个OH-,说明还消耗了水电离出的氢氧根,所以电极负极pH降低,故C正确;
D. 供电时,正极为NiOOH被还原,而不是水,故D错误;
故答案为D。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(![]() )中所含的中子数为NA
)中所含的中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法正确的是
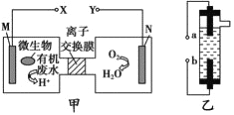
A. 装置乙中的b极要与装置甲的X极连接
B. 装置乙中a极的电极反应式为:2Cl- -2e-=Cl2↑
C. 当N极消耗5.6L(标准状况下)气体时,则有2NA个H+通过离子交换膜
D. 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)![]() 是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
(2)![]() 的键角由大到小的顺序为________________________,
的键角由大到小的顺序为________________________,![]() 的第一电离能由大到小的顺序为_______________________________。
的第一电离能由大到小的顺序为_______________________________。
(3)![]() 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
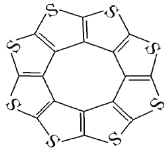
①![]() 分子中
分子中![]() 原子和
原子和![]() 原子的杂化轨道类型分别为_________________________。
原子的杂化轨道类型分别为_________________________。
②测得![]() 中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
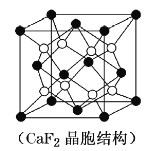
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,![]() 原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将
原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将![]() 原子等同看待,该晶体储氢后的晶胞结构与
原子等同看待,该晶体储氢后的晶胞结构与![]() (如图)相似,该晶体储氢后的化学式为_________________________。
(如图)相似,该晶体储氢后的化学式为_________________________。
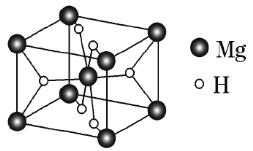
(5)![]() 是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为![]() ,则该晶胞的体积为___________
,则该晶胞的体积为___________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
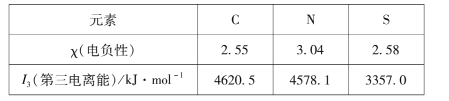
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
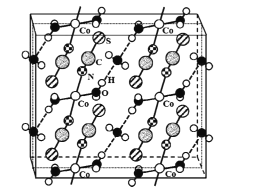
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—二异丙烯基苯![]() 是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
A.可以发生加成聚合反应B.不能使稀高锰酸钾溶液褪色
C.分子中所有原子共平面D.其苯环上的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
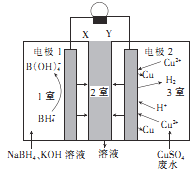
A.电极1为负极
B.Y为阳离子选择性交换膜
C.电极2上只有Cu析出
D.负极的电极反应式: ![]() +8
+8![]() 8
8![]() B
B![]() +4
+4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
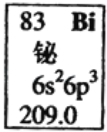
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com