
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
【答案】b、c 酸式滴定管 偏大 锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪色 0.5500
【解析】
(1)加水稀释、加入和醋酸反应的物质或加热都能促进醋酸的电离;
(2)①白醋的主要成分为CH3COOH,可用酸式滴定管量取;
②碱式滴定管没有润洗,导致标准液浓度减小,滴定时消耗标准液的体积偏大;
③用酚酞作指示剂,滴定终点前为无色,达到滴定终点时溶液变为浅红色,据此判断滴定终点的现象;
④三次滴定数据均有效,计算出消耗标准液的平均体积,然后结合c(醋酸)=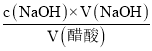 计算。
计算。
(1)加水稀释、加入和醋酸反应的物质或加热都能促进醋酸的电离,因此加入盐酸或醋酸钠都发生同离子效应而抑制醋酸的电离,因此正确的是b、c;
(2)①白醋的主要成分为CH3COOH,可用酸式滴定管量取;
②碱式滴定管没有润洗,导致标准液浓度减小,滴定时消耗标准液的体积偏大,导致测定结果比准确值偏大;
③用酚酞作指示剂,滴定终点前为无色,达到滴定终点时溶液变为浅红色,因此达到滴定终点时,锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪色;
④三次滴定数据均有效,消耗标准液的平均体积为![]() =22.00ml,那么该白醋样品中醋酸总酸度为c(醋酸)=
=22.00ml,那么该白醋样品中醋酸总酸度为c(醋酸)=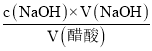 =
=![]() =0.5500mol/L。
=0.5500mol/L。


科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置有洗气、储气等用途。在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水。对该装置的说法正确的是
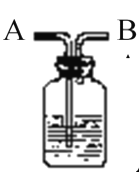
A.导管B连接供给氧气的钢瓶
B.导管B连接病人吸氧气的塑胶管
C.可用来观察输出氧气的速度
D.可用来调节输出氧气的速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的下列性质中,可以证明它是弱电解质的是( )
![]() 大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;![]() 醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥B.②④⑥C.①②④D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸
B.SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同
C.可用CuSO4溶液除去制乙炔时混有的杂质H2S
D.在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解答下列问题:
Ⅰ.某同学做如下实验![]() 图
图![]() ,以检验反应中的能量变化。
,以检验反应中的能量变化。

(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 ______ 热反应;该反应中 ______ 能转化成 ______ 能。
(2)(b)中温度降低,下列各图![]() 图
图![]() 所表示的反应是(b)反应的是 ______ 。
所表示的反应是(b)反应的是 ______ 。
Ⅱ.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图3所示。
(1)该反应中 ______ 是反应物,反应是 ______ 反应。
(2)反应开始到10s,用Z表示的反应速率为 ______ ![]() 。
。
(3)反应开始到10s时,Y的物质的量浓度减少了 ______ ![]() 。
。
(4)反应的化学方程式为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com