
【题目】醋酸的下列性质中,可以证明它是弱电解质的是( )
![]() 大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;![]() 醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥B.②④⑥C.①②④D.②⑥
【答案】B
【解析】
试题①pH相同,说明两溶液中的H+浓度相同,与同样的锌反应时产生H2的起始速率相同,无法证明醋酸是否已完全电离,故不能证明醋酸是弱电解质;②若为强酸,常温下0.1 mol·L-1的一元酸, pH=1,而醋酸的pH=3,证明醋酸未完全电离,是弱电解质,故可以证明醋酸是弱电解质;③酸碱的物质的量相同,完全发生中和反应,与酸的强弱无关,不能证明为弱酸,故不能证明醋酸是弱电解质;④常温下,测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故可以证明醋酸是弱电解质;⑤溶液的导电能力与溶液中离子浓度有关,与电解质的强弱无关,故不能证明醋酸是弱电解质;⑥由于醋酸是弱酸,因此pH=1的醋酸浓度比盐酸大,所以稀释相同倍数后,醋酸会继续电离出H+,因此醋酸的pH变化较小,故可以证明醋酸是弱电解质;故选B。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
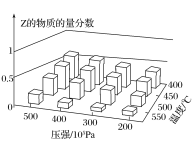
A.ΔH>0
B.m+n<c
C.升高温度,正、逆反应速率都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为(填序号)___。
(2)浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中的H+浓度由大到小的顺序是(填序号)___。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=___。
(4)将FeCl3、NaHCO3、K2SO3溶液蒸干、灼烧后得到的固体物质分别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。用下图所示装置进行第一组实验。
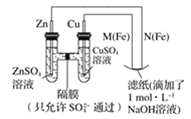
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是_____(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N 极发生反应的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com