
����Ŀ��Ϊ̽����������Է�Ӧ��mA(g)��nB(g)![]() cZ(g)��H��Ӱ�죬��A��B�����ʵ���֮��Ϊm��n��ʼ��Ӧ��ͨ��ʵ��õ���ͬ�����·�Ӧ�ﵽƽ��ʱZ�����ʵ���������ʵ������ͼ��ʾ�������ж���ȷ���ǣ� ��
cZ(g)��H��Ӱ�죬��A��B�����ʵ���֮��Ϊm��n��ʼ��Ӧ��ͨ��ʵ��õ���ͬ�����·�Ӧ�ﵽƽ��ʱZ�����ʵ���������ʵ������ͼ��ʾ�������ж���ȷ���ǣ� ��
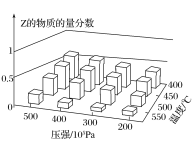
A.��H>0
B.m��n<c
C.�����¶ȣ������淴Ӧ���ʶ�����ƽ�ⳣ����С
D.���º�ѹʱ�����Ѵ�ƽ�����ϵ�м�������Z(g)���ٴδﵽƽ���Z�����ʵ�����������
���𰸡�C
��������
A. ��ͼ���֪���¶����ߣ�Z�����ʵ��������������ͣ�˵������Ӧ�Ƿ��ȵģ�����H��0����A����
B. ����Ӧ�Ƿ��ȵģ�����H��0����Сѹǿ����ѧƽ������������ϵ�������ӵķ�����еģ�������m+n��c����B����
C. �����¶����淴Ӧ���ʶ��ӿ죬��������Ӧ�Ƿ��ȷ�Ӧ������ƽ�ⳣ����С����C��ȷ��
D. �ں��º��������£����Ѵﵽƽ�����ϵ�м�������Z(g)���൱������ѹǿ��ƽ�������ƶ�����Z�ĺ�������D����
��ȷ����C��


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����M��N��P��Q�Ŀ����Ƭ����������ʵ�飺
�� M��N�õ���������ͬʱ��������ͭ��Һ�У�N�����
��P��Q�õ���������ͬʱ����ϡ![]() �У�Q�ǵ��������һ��
�У�Q�ǵ��������һ��
��M��P������ͬʱ����ϡ![]() ��P��������������
��P��������������
��N��Q������ͬʱ����ϡ![]() �У�Q������������Ӧ
�У�Q������������Ӧ
�����ֽ����Ļ��˳��Ϊ
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����(����)
A.��0.1 mol��L��1 CH3COOH��Һ�м�������ˮ����Һ�� ����
����
B.��CH3COONa��Һ��20 ��������30 ������Һ��![]() ����
����
C.�������м��백ˮ�����ԣ���Һ��![]() >1
>1
D.0.1 mol AgCl��0.1 mol AgI��Ϻ����1 Lˮ��������Һ��c(Cl��)��c(I��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У���ش��������⣺
��1��NH4Al(SO4)2������ˮ������ԭ����_____________________________________�����������ӷ���ʽ�����ֽ���������
��2����ͬ�����£�0.1molL��1NH4Al(SO4)2��c(NH4+)________________��������������������������С������0.1molL��1 NH4HCO3��c(NH4+)��
��3����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ��
�����з���0.1molL��1NH4Al(SO4)2��pH���¶ȱ仯��������__________����д��ţ���
��25��ʱ��0.1molL��1NH4Al(SO4)2��2c(SO42��)��c(NH4+)��3c(Al3+)=__________________ molL��1��д����ȷ�������
��4������ʱ����100mL 0.1molL��1 NH4HSO4��Һ�еμ�0.1molL��1 NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ2��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������__________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����______________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��Ӧ����ʾ��ͼ�����������������

A.���ɵ�M��E�ķ��Ӹ�����Ϊl��1
B.��Ӧ�У���Ԫ�غ�̼Ԫ�صĻ��ϼ۷����˸ı�
C.��Ӧǰ��Ԫ�ص�����û�иı䣬ԭ�ӵĸ��������˸ı�
D.R��M�Ļ�ѧ���ʲ�ͬ�������ԭ���Ƿ��Ӳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������У�����֤������������ʵ��ǣ� ��
![]() ��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��
��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��![]() ������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
A.�ڢܢݢ�B.�ڢܢ�C.�٢ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(BCl3)��һ����Ҫ�Ļ���ԭ�ϡ�ʵ�����Ʊ�BCl3��ԭ��B2O3+3C+3Cl2 =2BCl3+3CO��ijʵ��С�����ø��������������װ�ã�װ�ÿ��ظ�ʹ�ã��Ʊ�BCl3����֤��Ӧ����CO���ɡ���֪��BCl3���۵�Ϊ-107.3�棬�е�Ϊ12.5�棬��ˮˮ������H3BO3��HCl����ش��������⣺
��ʵ����Ʊ�BCl3����֤����CO

(1)��ʵ��װ���к���������˳��ΪG��_____��_____��_____��____��F��D��I������װ��E��������___________________________��
(2)װ��J�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ʵ���Ʒ���Ⱥ����IJⶨ
��ȷ��ȡ����m�˲�Ʒ����������ˮ����ȫˮ�⣬�����100mL��Һ��
��ȡ10.00mL��Һ����ƿ��
�ۼ���V1mLŨ��ΪC1 mol/LAgNO3��Һʹ��������ȫ�����������м�����������������ҡ����
����������Ϊָʾ������C2 mol/L KSCN����Һ�ζ�������AgNO3��Һ��������Ӧ��Ag+ +SCN- =AgSCN����
���ظ������~�ܶ��Σ��ﵽ�ζ��յ�ʱ��ȥKSCN��Һ��ƽ�����ΪV2 mL��
��֪: Ksp(AgCl)>Ksp(AgSCN) ��
(3)������дﵽ�ζ��յ������Ϊ__________________��
(4)ʵ������м�����������Ŀ����___________________��
(5)��Ʒ����Ԫ�ص���������Ϊ_________________%��
(6)���в��������������ò�Ʒ���Ⱥ���ƫ����__________��
A.��������������
B.�����������100mL��Һʱ������ʱ���ӿ̶���
C.��KSCN��Һ�ζ�ʣ��AgNO3��Һʱ���ζ�ǰ�����ݣ��ζ���������
D.�ζ�ʣ��AgNO3��Һʱ��KSCN��Һ�ε���ƿ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵��ǣ� ��

ѡ�� | �� | �� | �� | ʵ����� |
A | ϡ���� | CaCO3 | Na2SiO3��Һ | �ǽ�����:Cl>C>Si |
B | Ũ���� | ���� | Ba(NO3)2��Һ | ��֤SO2������Ա��ο����ɰ�ɫ���� |
C | Ũ��ˮ | ��ʯ�� | ��̪��Һ | ������ˮ��Һ�ʼ��� |
D | Ũ���� | Fe | NaOH��Һ | ����Ũ���ᷴӦ������NO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ��֪ʶ�о��������CO��SO2������Ҫ���塣
(1)��CO���Ժϳɼ״�����֪��
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ��H=-764.5 kJmol-1��
O2(g)=CO2(g)+2H2O(l) ��H=-764.5 kJmol-1��
CO(g)+![]() O2(g)=CO2(g) ��H=-283.0 kJmol-1��
O2(g)=CO2(g) ��H=-283.0 kJmol-1��
H2(g)+![]() O2(g)=H2O(l) ��H=-285.8kJmol-1��
O2(g)=H2O(l) ��H=-285.8kJmol-1��
��CO(g)+2H2(g)![]() CH3OH(g) ��H=___kJmol-1��
CH3OH(g) ��H=___kJmol-1��
(2)���д�ʩ���ܹ����������ϳɼ״���Ӧ�ķ�Ӧ���ʵ���___(��д���)��
a.ʹ�ô��� b.���ͷ�Ӧ�¶�
c.������ϵѹǿ d.���Ͻ�CH3OH�ӷ�Ӧ������з������
(3)��һ��ѹǿ�£��ݻ�ΪVL�������г���a mol CO��2a mol H2���ڴ��������·�Ӧ���ɼ�ȩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��
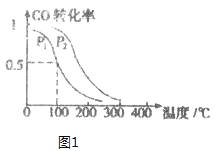
��P1___P2(����ڡ�����С�ڡ����ڡ�)��
��100��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=______��
��100�棬�ﵽƽ�����ѹǿP1���������£���������ͨ��CO��H2��CH3OH��0.5a mol����ƽ��___(��������������ҡ�)�ƶ���
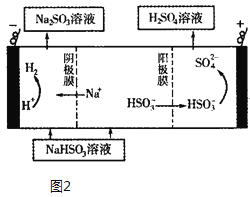
(4)����ԭ���ԭ������SO2��H2O���Ʊ����ᣬ�õ���ö�ײ������缫�������������壬ͬʱҲ��ʹ������������Һ��ֽӴ�����д���õ�صĸ����ĵ缫��Ӧʽ___��
(5)Na2SO3��Һ��CaCl2��Һ��ϻ��������ܵ�CaSO3(Ksp=3.1��10-7)���ֽ��������CaCl2��Һ��Na2SO3��Һ��ϣ������ǰNa2SO3��Һ��Ũ��Ϊ2��10-3 mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ______����Na2SO3��Һ�������SO2��NaHSO3��Һ��Ȼ�������Һ�����ԭ��ʾ��ͼ��ͼ2��ʾ����д���õ��ط�����Ӧ�Ļ�ѧ����ʽ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com