
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 增大
增大
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中所得溶液中c(Cl-)=c(I-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式___。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=___。
(3)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为:___;
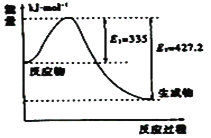
②若起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A.对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,升温ΔH不变
CO2(g)+H2(g) ΔH<0,升温ΔH不变
B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g) △H = -483.6 kJ/mol,则H2的燃烧热为 241.8 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 ,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是

A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在T农业生产中有重要的作用
(1)![]() 在空气屮灼烧可制得铁系氧化物材料。已知
在空气屮灼烧可制得铁系氧化物材料。已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
![]()
写出![]() 在空气中灼烧生成
在空气中灼烧生成![]() 的热化学方程式______
的热化学方程式______
(2)生产中常用CO还原铁的氧化物冶炼铁。T业上可利用甲烷与水蒸气反应制备CO原料气:![]() 。如图是
。如图是![]() 与
与![]() 初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
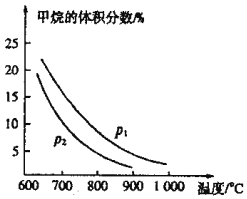
①甲烷与水蒸气反应制备CO的反应为______![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 反应,压强
反应,压强![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]()
②在恒温恒压的条件下,上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______
A.逆反应速率先增大后减小
B.混合气体的密度减小
C.化学平衡常数K值减小
D.水蒸气的转化率减小
③在恒温、恒容的条件下,向上述平衡体系中充人体积比为:3的甲烷与水蒸气混合气体,再次达到平衡时CO的体积分数______![]() 填“增大”、减小”或“不变”
填“增大”、减小”或“不变”![]() ,
,
(3)已知![]() 时,
时,![]() ,该温度下反应
,该温度下反应![]() 的平衡常数
的平衡常数![]() ______
______
(4)工业上通过电解浓NaOH溶液可制备![]() ,然后转化为
,然后转化为![]() ,电解原理如图所示,则A溶液中溶质的成分为______
,电解原理如图所示,则A溶液中溶质的成分为______![]() 填化学式
填化学式![]() :阳极的电极反应式为______
:阳极的电极反应式为______
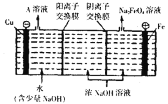 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
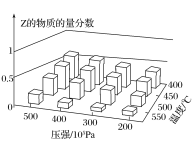
A.ΔH>0
B.m+n<c
C.升高温度,正、逆反应速率都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com