
【题目】下列有关热化学方程式的叙述中,正确的是( )
A.对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,升温ΔH不变
CO2(g)+H2(g) ΔH<0,升温ΔH不变
B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g) △H = -483.6 kJ/mol,则H2的燃烧热为 241.8 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 ,则△H1>△H2
【答案】A
【解析】
A选项,对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,ΔH只与反应物和生成物的总能量有关,与升温无关,故A正确;
CO2(g)+H2(g) ΔH<0,ΔH只与反应物和生成物的总能量有关,与升温无关,故A正确;
B选项,已知C(石墨,s)=C(金刚石,s)△H>0,是吸热反应,石墨能量低,因此石墨比金刚石稳定,故B错误;
C选项,已知2H2(g)十O2(g)=2H2O(g) △H = -483.6 kJ/mol,该反应是生成气态水,因此不是H2的燃烧热,故C错误;
D选项,已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 ,前者燃烧充分,放出的热量更多,焓变反而越小,因此△H2>△H1,故D错误。
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】Ⅰ.在常温下,下列四种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4④0.1mol/L NH3H2O,请根据要求填写下列空白:
(1)溶液①呈____ 性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)。
(2)在上述四种溶液中,pH最小的是________。
(3)比较四种溶液中c(NH4+)的由大到小的顺序是______________(填序号)。
(4)四种溶液中,离子浓度为0.1 mol/L的是___________(填离子符号)。
Ⅱ. KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所述:称取稍多于所需要的KMnO4固体溶于水中,将溶液加热并保持微沸1h;用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;过滤得到的KMnO4溶液贮存于棕色试剂瓶中并放在暗处;利用氧化还原反应滴定法,在70~80℃条件下用基准试剂溶液标定其浓度.
请回答下列问题:
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是_____________。
(2)若选择H2C2O4 2H2O(M=126g/mol)作为基准试剂,准确称取Wg溶于水配成500mL溶液,配制溶液时,所用仪器除烧杯、胶头滴管和玻璃棒外,还需要_______。取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL,则KMnO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为原料生产重铬酸钠
为原料生产重铬酸钠![]() ,其流程如图1:
,其流程如图1:
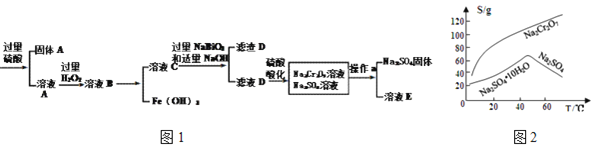
查阅资料得知:
①常温下,![]() 难溶于水,有强氧化性。
难溶于水,有强氧化性。
②常温下,![]()
③物质溶解度曲线如图2所示。
回答下列问题:
(1)![]() 铬的价态是______,
铬的价态是______,![]() 的电子式为______。
的电子式为______。
(2)![]() 的作用______。
的作用______。
(3)滤渣D的成分是______。
(4)操作a的名称是______、______。
(5)电镀厂产生的镀铜废水中往往含有一定量的![]() 处理该废水的流程为:含
处理该废水的流程为:含![]() 的废水
的废水![]() 含
含![]() 的废水
的废水![]() Cr(OH)3沉淀
Cr(OH)3沉淀
①流程中,![]() 参与反应的离子方程式______。
参与反应的离子方程式______。
②![]() ______,
______,![]() 已沉淀完全
已沉淀完全![]() 此时
此时![]() ;若
;若![]() 时,
时,![]() 开始溶解,溶解时的离子方程式为______。
开始溶解,溶解时的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 增大
增大
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________________________________。(请用离子方程式加文字进行描述)
(2)相同条件下,0.1molL﹣1NH4Al(SO4)2中c(NH4+)________________(填“等于”、“大于”或“小于”)0.1molL﹣1 NH4HCO3中c(NH4+)。
(3)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是__________(填写序号)。
②25℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=__________________ molL﹣1(写出精确结果)。
(4)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a、b、c、d四个点,水的电离程度最大是__________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com