
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________________________________。(请用离子方程式加文字进行描述)
(2)相同条件下,0.1molL﹣1NH4Al(SO4)2中c(NH4+)________________(填“等于”、“大于”或“小于”)0.1molL﹣1 NH4HCO3中c(NH4+)。
(3)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是__________(填写序号)。
②25℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=__________________ molL﹣1(写出精确结果)。
(4)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a、b、c、d四个点,水的电离程度最大是__________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。

【答案】Al3+ + 3H2O![]() Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能 大于 I (1×10-3molL-1 - 1×10-11) molL-1 a c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)
Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能 大于 I (1×10-3molL-1 - 1×10-11) molL-1 a c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)
【解析】
⑴NH4Al(SO4)2可作净水剂,其原理是Al3+ + 3H2O![]() Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能。
Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能。
⑵0.1molL﹣1NH4Al(SO4)2中铵根离子、铝离子水解是相互抑制的,水解程度比NH4HCO3中铵根离子水解程度小,剩余多,因此c(NH4+)大于0.1molL﹣1 NH4HCO3中c(NH4+)。
⑶①NH4Al(SO4)2水解显酸性,温度升高,酸性增强,pH减小,因此0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是I。
②25℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)= c(H+) - c(OH-) = 1×10-3molL-1 - 1×10-11molL-1 = (1×10-3molL-1 - 1×10-11) molL-1。
⑷室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a点溶质为硫酸铵、硫酸钠,促进水的电离,b点溶质为硫酸铵、硫酸钠、氨水,铵根水解和一水合氨电离程度相当,c点溶质为硫酸铵、硫酸钠、氨水,抑制水的电离,d为硫酸钠和氨水,抑制水的电离,水的电离程度最大是a点;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)。
⑴NH4Al(SO4)2可作净水剂,其原理是Al3+ + 3H2O![]() Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能,故答案为:Al3+ + 3H2O
Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能,故答案为:Al3+ + 3H2O![]() Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能。
Al(OH)3(胶体) +3 H+,铝离子水解生成氢氧化铝胶体,胶体具有吸附杂质功能。
⑵0.1molL﹣1NH4Al(SO4)2中铵根离子、铝离子水解是相互抑制的,水解程度比NH4HCO3中铵根离子水解程度小,剩余多,因此c(NH4+)大于0.1molL﹣1 NH4HCO3中c(NH4+),故答案为:大于。
⑶①NH4Al(SO4)2水解显酸性,温度升高,酸性增强,pH减小,因此0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是I,故答案为:I。
②25℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)= c(H+) - c(OH-) = 1×10-3molL-1 - 1×10-11molL-1 = (1×10-3molL-1 - 1×10-11) molL-1,故答案为:(1×10-3molL-1 - 1×10-11) molL-1。
⑷室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a点溶质为硫酸铵、硫酸钠,促进水的电离,b点溶质为硫酸铵、硫酸钠、氨水,铵根水解和一水合氨电离程度相当,c点溶质为硫酸铵、硫酸钠、氨水,抑制水的电离,d为硫酸钠和氨水,抑制水的电离,水的电离程度最大是a点;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-),故答案为a:c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.催化剂既能改变化学反应速率又能改变化学反应限度
B.升高温度能改变工业合成氨的反应速率
C.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
D.把锌粒放入盛有稀盐酸的试管中,加入几滴氯化铜溶液,能加快生成![]() 的速率
的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A.对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,升温ΔH不变
CO2(g)+H2(g) ΔH<0,升温ΔH不变
B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g) △H = -483.6 kJ/mol,则H2的燃烧热为 241.8 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 ,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在T农业生产中有重要的作用
(1)![]() 在空气屮灼烧可制得铁系氧化物材料。已知
在空气屮灼烧可制得铁系氧化物材料。已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
![]()
写出![]() 在空气中灼烧生成
在空气中灼烧生成![]() 的热化学方程式______
的热化学方程式______
(2)生产中常用CO还原铁的氧化物冶炼铁。T业上可利用甲烷与水蒸气反应制备CO原料气:![]() 。如图是
。如图是![]() 与
与![]() 初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
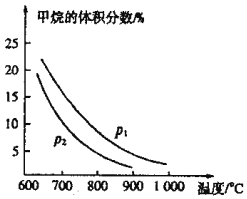
①甲烷与水蒸气反应制备CO的反应为______![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 反应,压强
反应,压强![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]()
②在恒温恒压的条件下,上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______
A.逆反应速率先增大后减小
B.混合气体的密度减小
C.化学平衡常数K值减小
D.水蒸气的转化率减小
③在恒温、恒容的条件下,向上述平衡体系中充人体积比为:3的甲烷与水蒸气混合气体,再次达到平衡时CO的体积分数______![]() 填“增大”、减小”或“不变”
填“增大”、减小”或“不变”![]() ,
,
(3)已知![]() 时,
时,![]() ,该温度下反应
,该温度下反应![]() 的平衡常数
的平衡常数![]() ______
______
(4)工业上通过电解浓NaOH溶液可制备![]() ,然后转化为
,然后转化为![]() ,电解原理如图所示,则A溶液中溶质的成分为______
,电解原理如图所示,则A溶液中溶质的成分为______![]() 填化学式
填化学式![]() :阳极的电极反应式为______
:阳极的电极反应式为______
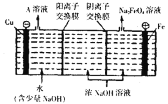 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
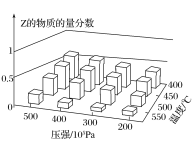
A.ΔH>0
B.m+n<c
C.升高温度,正、逆反应速率都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为(填序号)___。
(2)浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中的H+浓度由大到小的顺序是(填序号)___。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=___。
(4)将FeCl3、NaHCO3、K2SO3溶液蒸干、灼烧后得到的固体物质分别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中一lg![]() 和一lgc(HC2O42-)[或-lg
和一lgc(HC2O42-)[或-lg![]() 和-1gc(C2O42-)]的关系如图所示。下列说法正确的是
和-1gc(C2O42-)]的关系如图所示。下列说法正确的是

A. Ka1(H2C2O4)数量级为10-1
B. 曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中C(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com