
����Ŀ�������仯������Tũҵ����������Ҫ������
(1)![]() �ڿ��������տ��Ƶ���ϵ��������ϡ���֪
�ڿ��������տ��Ƶ���ϵ��������ϡ���֪![]() ��101kPaʱ��
��101kPaʱ��
![]()
![]()
![]()
![]()
д��![]() �ڿ�������������
�ڿ�������������![]() ���Ȼ�ѧ����ʽ______
���Ȼ�ѧ����ʽ______
(2)�����г���CO��ԭ����������ұ������Tҵ�Ͽ����ü�����ˮ������Ӧ�Ʊ�COԭ������![]() ����ͼ��
����ͼ��![]() ��
��![]() ��ʼ�����Ϊ1��3ʱ������ϵ�м��������������¶ȡ�ѹǿӰ��Ĺ�ϵͼ��
��ʼ�����Ϊ1��3ʱ������ϵ�м��������������¶ȡ�ѹǿӰ��Ĺ�ϵͼ��
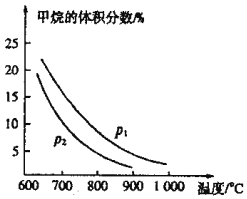
�ټ�����ˮ������Ӧ�Ʊ�CO�ķ�ӦΪ______![]() ��������������������
��������������������![]() ��Ӧ��ѹǿ
��Ӧ��ѹǿ![]() ______
______![]() ����
����![]() ������
������![]() ��
��![]()
���ں��º�ѹ�������£�������Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ�����______
A.�淴Ӧ������������С
B.���������ܶȼ�С
C.��ѧƽ�ⳣ��Kֵ��С
D.ˮ������ת���ʼ�С
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�ٴδﵽƽ��ʱCO���������______![]() ��������������С������������
��������������������������![]() ��
��
(3)��֪![]() ʱ��
ʱ��![]() �����¶��·�Ӧ
�����¶��·�Ӧ![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ______
______
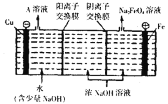
(4)��ҵ��ͨ�����ŨNaOH��Һ���Ʊ�![]() ��Ȼ��ת��Ϊ
��Ȼ��ת��Ϊ![]() �����ԭ����ͼ��ʾ����A��Һ�����ʵijɷ�Ϊ______
�����ԭ����ͼ��ʾ����A��Һ�����ʵijɷ�Ϊ______![]() �ѧʽ
�ѧʽ![]() �������ĵ缫��ӦʽΪ______
�������ĵ缫��ӦʽΪ______
 .
.
���𰸡�![]() ����
���� ![]() AC ��С
AC ��С ![]() NaOH
NaOH ![]()
��������
![]() �����֪��Ӧ�����ݸ�˹���ɣ���д�Ȼ�ѧ����ʽ��
�����֪��Ӧ�����ݸ�˹���ɣ���д�Ȼ�ѧ����ʽ��
![]() �ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ������������������
�ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ������������������
��A���淴Ӧ������������С��˵����Ӧ������У�
B�����������������䣬���ܶȼ�С��˵�����������������
C����ѧƽ�ⳣ��Kֵ��С��ƽ�����ƣ�
D������ˮ����Ũ�ȣ�ƽ�����ƣ�ˮ������ת����Ҳ���С��
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�൱�ڽ���������ѹ����
![]() ����ƽ�ⳣ���ĸ����Ϸ�Ӧд������ʽ����ƽ��Ũ�ȵõ���
����ƽ�ⳣ���ĸ����Ϸ�Ӧд������ʽ����ƽ��Ũ�ȵõ���
![]() �缫�������������ϵ缫��ӦʽΪ
�缫�������������ϵ缫��ӦʽΪ![]() ��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������Feʧ���Ӻ�
��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������Feʧ���Ӻ�![]() ��Ӧ����
��Ӧ����![]() ��
��
![]() ���ݸ�˹���ɣ�����Ӧ��
���ݸ�˹���ɣ�����Ӧ��![]() ����
����![]() ����
����![]() ����
�У���![]() �ɵ��ȷ�Ӧ����ʽΪ
�ɵ��ȷ�Ӧ����ʽΪ![]() ��
��
![]() �ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ��������¶ȣ�ƽ�����ƣ���˷�ӦΪ���ȷ�Ӧ�����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ��������������Խ��
�ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ��������¶ȣ�ƽ�����ƣ���˷�ӦΪ���ȷ�Ӧ�����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ��������������Խ��![]() ��
��
��A���淴Ӧ������������С��˵���ı䷴Ӧ����������Ӧ����������Ӧ������У����淴Ӧ�����ɼ�С����A��ȷ��
B�����������������䣬���ܶȼ�С��˵���������������������Ӧ�����������������ķ���ƽ�����ƣ���B����
C����ѧƽ�ⳣ�� ��Kֵ��С��˵��ƽ�����ƣ���C��ȷ��
��Kֵ��С��˵��ƽ�����ƣ���C��ȷ��
D������ˮ����Ũ�ȣ�ƽ�����ƣ�ˮ������ת����Ҳ���С����ˮ������ת���ʼ�С��һ����ƽ���������𣬹�D����
�ʴ�AC��
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�൱�ڽ���������ѹ������ƽ�����ƣ����ٴδﵽƽ��ʱCO�������������С��
![]() ����Ӧ
����Ӧ![]() ��ƽ�ⳣ��
��ƽ�ⳣ��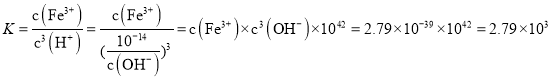 ��
��
![]() �缫�������������ϵ缫��ӦʽΪ
�缫�������������ϵ缫��ӦʽΪ![]() ��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������������Һ������ΪNaOH��������Feʧ���Ӻ�
��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������������Һ������ΪNaOH��������Feʧ���Ӻ�![]() ��Ӧ����
��Ӧ����![]() ���缫��ӦʽΪ
���缫��ӦʽΪ![]() ��
��


 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ������£�NCl3��һ����״Һ�壬����ӿռ乹����NH3���ƣ����ж�NCl3��NH3���й������������
A.������N��Cl��������CCl4������C��Cl�����������
B.NCl3�����Ǽ��Է���
C.NBr3��NCl3�ӷ�
D.�ڰ�ˮ�У���NH3��H2O�����(����![]() ����ʾ)����γ�NH3H2O���ӣ���NH3H2O�ĽṹʽΪ
����ʾ)����γ�NH3H2O���ӣ���NH3H2O�ĽṹʽΪ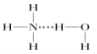
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ��ijƽ����ϵ�к���X��Y��Z��W�������ʣ����¶��·�����Ӧ��ƽ�ⳣ������ʽΪK��![]() ���йظ�ƽ����ϵ��˵����ȷ����
���йظ�ƽ����ϵ��˵����ȷ����
A. ����������ƽ����Է����������ֲ���ʱ����Ӧ��ƽ��
B. ����ѹǿ�������ʵ�Ũ�Ȳ���
C. �����¶ȣ�ƽ�ⳣ��K����
D. ����X������ƽ��ȿ��������ƶ���Ҳ���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����(����)
A.��0.1 mol��L��1 CH3COOH��Һ�м�������ˮ����Һ�� ����
����
B.��CH3COONa��Һ��20 ��������30 ������Һ��![]() ����
����
C.�������м��백ˮ�����ԣ���Һ��![]() >1
>1
D.0.1 mol AgCl��0.1 mol AgI��Ϻ����1 Lˮ��������Һ��c(Cl��)��c(I��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ԥ��ʵ��Ŀ�Ļ�����ʵ�����һ�µ���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | �������� | ��ȥ |
B | ��ij��Һ�м��� | ֤����Һ�к� |
C | ��ij��Һ�м���ϡ���ᣬ�ų���ɫ��ζ���壬������ͨ�����ʯ��ˮ��ʯ��ˮ����� | ֤������Һ�д��� |
D | �� | ֤�� |
A.AB.BC.CD.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У���ش��������⣺
��1��NH4Al(SO4)2������ˮ������ԭ����_____________________________________�����������ӷ���ʽ�����ֽ���������
��2����ͬ�����£�0.1molL��1NH4Al(SO4)2��c(NH4+)________________��������������������������С������0.1molL��1 NH4HCO3��c(NH4+)��
��3����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ��
�����з���0.1molL��1NH4Al(SO4)2��pH���¶ȱ仯��������__________����д��ţ���
��25��ʱ��0.1molL��1NH4Al(SO4)2��2c(SO42��)��c(NH4+)��3c(Al3+)=__________________ molL��1��д����ȷ�������
��4������ʱ����100mL 0.1molL��1 NH4HSO4��Һ�еμ�0.1molL��1 NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ2��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������__________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����______________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��Ӧ����ʾ��ͼ�����������������

A.���ɵ�M��E�ķ��Ӹ�����Ϊl��1
B.��Ӧ�У���Ԫ�غ�̼Ԫ�صĻ��ϼ۷����˸ı�
C.��Ӧǰ��Ԫ�ص�����û�иı䣬ԭ�ӵĸ��������˸ı�
D.R��M�Ļ�ѧ���ʲ�ͬ�������ԭ���Ƿ��Ӳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(BCl3)��һ����Ҫ�Ļ���ԭ�ϡ�ʵ�����Ʊ�BCl3��ԭ��B2O3+3C+3Cl2 =2BCl3+3CO��ijʵ��С�����ø��������������װ�ã�װ�ÿ��ظ�ʹ�ã��Ʊ�BCl3����֤��Ӧ����CO���ɡ���֪��BCl3���۵�Ϊ-107.3�棬�е�Ϊ12.5�棬��ˮˮ������H3BO3��HCl����ش��������⣺
��ʵ����Ʊ�BCl3����֤����CO

(1)��ʵ��װ���к���������˳��ΪG��_____��_____��_____��____��F��D��I������װ��E��������___________________________��
(2)װ��J�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ʵ���Ʒ���Ⱥ����IJⶨ
��ȷ��ȡ����m�˲�Ʒ����������ˮ����ȫˮ�⣬�����100mL��Һ��
��ȡ10.00mL��Һ����ƿ��
�ۼ���V1mLŨ��ΪC1 mol/LAgNO3��Һʹ��������ȫ�����������м�����������������ҡ����
����������Ϊָʾ������C2 mol/L KSCN����Һ�ζ�������AgNO3��Һ��������Ӧ��Ag+ +SCN- =AgSCN����
���ظ������~�ܶ��Σ��ﵽ�ζ��յ�ʱ��ȥKSCN��Һ��ƽ�����ΪV2 mL��
��֪: Ksp(AgCl)>Ksp(AgSCN) ��
(3)������дﵽ�ζ��յ������Ϊ__________________��
(4)ʵ������м�����������Ŀ����___________________��
(5)��Ʒ����Ԫ�ص���������Ϊ_________________%��
(6)���в��������������ò�Ʒ���Ⱥ���ƫ����__________��
A.��������������
B.�����������100mL��Һʱ������ʱ���ӿ̶���
C.��KSCN��Һ�ζ�ʣ��AgNO3��Һʱ���ζ�ǰ�����ݣ��ζ���������
D.�ζ�ʣ��AgNO3��Һʱ��KSCN��Һ�ε���ƿ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25��ʱijЩ�ε�Ũ�Ȼ�����������ĵ���ƽ�ⳣ��������˵����ȷ����
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. ��Ũ�Ⱦ�Ϊl��10-3mol/L��KCl��K2CrO4���Һ�еμ�l��10-3mol/LAgNO3��Һ��CrO42-���γɳ���
C. ̼������Һ�еμ�������ˮ�����ӷ���ʽΪCO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. ��0.1mol/LCH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=5:9����ʱ��ҺpH=5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com