
����Ŀ�����ᣨH2C2O4����һ����Ҫ�Ķ�Ԫ���ᣬ����һ����Ҫ�Ļ�ԭ�������ἰ�������ڹ�ũҵ��������ѧ�о�������й㷺Ӧ�á����ò��ἰ�����ε����ʿɲⶨ����ѪҺ�и����ӵ�Ũ�ȡ��������£���ȡһ�������Ѫ�����������IJ���泥�(NH4)2C2O4����Һ������������Ƴ��������˲���Ƴ���ϴ�Ӻ�����ǿ��ɵò��ᣬ������֪Ũ�ȵ�����KMnO4��Һ�ζ���ʹ����ת����CO2�ݳ����������ĵ�KMnO4��Һ��������ɲⶨѪҺ��Ʒ��Ca2+��Ũ�ȡ�
��1��д������������KMnO4��Һ��Ӧ�����ӷ���ʽ______________________________________ ��
��2����ȡѪ��10.00mL����������������õ����ᣬ���������ữ��0.010mol/L KMnO4��Һ�ζ�,ȷ����Ӧ�ﵽ�յ��������_______________________________________________________��
��3���ζ�����������12.00mL KMnO4��Һ����ѪҺ��Ʒ��Ca2+���ӵ�Ũ��Ϊ______mg/mL��
��4�����в�������ʹ���ⶨ���ƫ�ߵ���_________��
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע�����Ը��������Һ
B���ζ�ǰʢ�Ŵ���Һ����ƿ������ˮϴ����δ����
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D���ζ��������ȡ��Һ���ʱ�����Ӷ���
���𰸡�2MnO4�� + 6H+ + 5H2C2O4 = 2Mn2+ + 8H2O + 10CO2 �������һ����Һ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���Ϊԭ����ɫ 1.2 AC
��������
�Ų���������KMnO4��Һ��Ӧ���������ӡ�������̼��ˮ�������ӷ���ʽ2MnO4�� + 6H+ + 6H2C2O4 = 2Mn2+ + 8H2O + 10CO2��
�Ƴ�ȡѪ��10.00mL����������������õ����ᣬ���������ữ��0.010mol/L KMnO4��Һ�ζ���ȷ����Ӧ�ﵽ�յ�������ǵ������һ����Һ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���Ϊԭ����ɫ��
��
5Ca2+���� 5H2C2O4����2MnO4��
5mol 2mol
xmol 0.010mol/L��0.012L
![]()
���x = 3��10-4mol
10mLѪҺ�к���Ca2+���ӵ�����Ϊ3��10-4mol ��40g/mol = 1.2��10-2g����ѪҺ��Ʒ��Ca2+���ӵ�Ũ��Ϊ1.2��10-2��103 mg/10mL = 1.2mg/mL��
��Aѡ���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע�����Ը��������Һ��Ũ�ȼ�С������Ҫ��������࣬����Ũ��ƫ�ߣ�Bѡ��ζ�ǰʢ�Ŵ���Һ����ƿ������ˮϴ����δ�����Ӱ�죻Cѡ���ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����������ƫ�����Ũ��ƫ�ߣ�Dѡ��ζ��������ȡ��Һ���ʱ�����Ӷ���������ƫС��������ƫ�ߡ�
�Ų���������KMnO4��Һ��Ӧ���������ӡ�������̼��ˮ�������ӷ���ʽ2MnO4�� + 6H+ + 6H2C2O4 = 2Mn2+ + 8H2O + 10CO2���ʴ�Ϊ: 2MnO4�� + 6H+ + 5H2C2O4 = 2Mn2+ + 8H2O + 10CO2��
�Ƴ�ȡѪ��10.00mL����������������õ����ᣬ���������ữ��0.010mol/L KMnO4��Һ�ζ���ȷ����Ӧ�ﵽ�յ�������ǵ������һ����Һ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���Ϊԭ����ɫ���ʴ�Ϊ���������һ����Һ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���Ϊԭ����ɫ��
��
5Ca2+���� 5H2C2O4����2MnO4��
5mol 2mol
xmol 0.010mol/L��0.012L
![]()
���x = 6��10-4mol
10mLѪҺ�к���Ca2+���ӵ�����Ϊ6��10-4mol ��40g/mol = 2.4��10-2g����ѪҺ��Ʒ��Ca2+���ӵ�Ũ��Ϊ2.4��10-2��103 mg/10mL = 2.4mg/mL���ʴ�Ϊ��2.4��
��Aѡ���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע�����Ը��������Һ��Ũ�ȼ�С������Ҫ��������࣬����Ũ��ƫ�ߣ�Bѡ��ζ�ǰʢ�Ŵ���Һ����ƿ������ˮϴ����δ�����Ӱ�죻Cѡ���ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����������ƫ�����Ũ��ƫ�ߣ�Dѡ��ζ��������ȡ��Һ���ʱ�����Ӷ���������ƫС��������ƫ�ߣ��ʴ�Ϊ��AC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1 molij��ѧ�������ĵ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȡ�
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
��ҵ�ϸߴ����ͨ�����з�Ӧ��ȡ��SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ�ȡ�HΪ
Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ�ȡ�HΪ
A. ��236 kJ��mol��1B. ��236 kJ��mol��1
C. ��412 kJ��mol��1D. ��412 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ը�����![]() ��Ҫ�ɷ�Ϊ
��Ҫ�ɷ�Ϊ![]() ������
������![]() ��
��![]() ������
������![]() Ϊԭ�������ظ�����
Ϊԭ�������ظ�����![]() ����������ͼ1��
����������ͼ1��
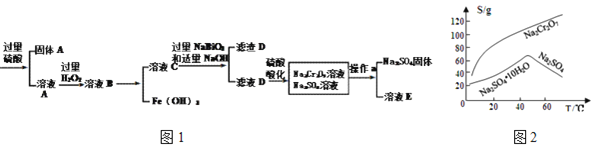
�������ϵ�֪��
�ٳ����£�![]() ������ˮ����ǿ�����ԡ�
������ˮ����ǿ�����ԡ�
�ڳ����£�![]()
�������ܽ��������ͼ2��ʾ��
�ش��������⣺
(1)![]() ���ļ�̬��______��
���ļ�̬��______��![]() �ĵ���ʽΪ______��
�ĵ���ʽΪ______��
(2)![]() ������______��
������______��
(3)����D�ijɷ���______��
(4)����a��������______��______��
(5)��Ƴ������Ķ�ͭ��ˮ����������һ������![]() �����÷�ˮ������Ϊ����
�����÷�ˮ������Ϊ����![]() �ķ�ˮ
�ķ�ˮ![]() ��
��![]() �ķ�ˮ
�ķ�ˮ![]() Cr(OH)3����
Cr(OH)3����
�������У�![]() ���뷴Ӧ�����ӷ���ʽ______��
���뷴Ӧ�����ӷ���ʽ______��
��![]() ______��
______��![]() �ѳ�����ȫ
�ѳ�����ȫ![]() ��ʱ
��ʱ![]() ����
����![]() ʱ��
ʱ��![]() ��ʼ�ܽ⣬�ܽ�ʱ�����ӷ���ʽΪ______��
��ʼ�ܽ⣬�ܽ�ʱ�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���4.0 L�����ܱ������г���2.0 mol PCl5����ӦPCl5(g) ![]() PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
ʱ��/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
����˵����ȷ����(�� ��)
A.��Ӧ��ǰ50 s��ƽ����Ӧ����Ϊv(PCl3)��0.006 4 mol/(L��s)
B.��ͬ�¶��£���ʼʱ��������г���2.0 mol PCl5��0.4 mol PCl3��0.40 mol Cl2���ﵽƽ��ǰv(��)>v(��)
C.��ͬ�¶��£���ʼʱ��������г���4.0 mol PCl3��4.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80%
D.���������������䣬�����¶ȣ�ƽ��ʱ��c(PCl3)��0.11 mol/L����Ӧ����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У���ش��������⣺
��1��NH4Al(SO4)2������ˮ������ԭ����_____________________________________�����������ӷ���ʽ�����ֽ���������
��2����ͬ�����£�0.1molL��1NH4Al(SO4)2��c(NH4+)________________��������������������������С������0.1molL��1 NH4HCO3��c(NH4+)��
��3����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ��
�����з���0.1molL��1NH4Al(SO4)2��pH���¶ȱ仯��������__________����д��ţ���
��25��ʱ��0.1molL��1NH4Al(SO4)2��2c(SO42��)��c(NH4+)��3c(Al3+)=__________________ molL��1��д����ȷ�������
��4������ʱ����100mL 0.1molL��1 NH4HSO4��Һ�еμ�0.1molL��1 NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ2��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������__________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����______________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ����ϴ������������;����ҽԺ������������ʱ��Ҳ���������Ƶ�װ�ã�����װ����ʢ�Ŵ�Լ��ƿ����ˮ���Ը�װ�õ�˵����ȷ����
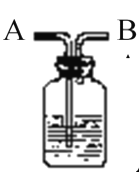
A.����B���ӹ��������ĸ�ƿ
B.����B���Ӳ������������ܽ���
C.�������۲�����������ٶ�
D.��������������������ٶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������У�����֤������������ʵ��ǣ� ��
![]() ��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��
��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��![]() ������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
A.�ڢܢݢ�B.�ڢܢ�C.�٢ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Һ�к�����������(�������ᷴӦ)�������к͵ζ��ⶨ��Ũ�ȡ�
��1����_______ʽ�ζ���ʢװc mol/L�����Һ������c mol/L�����Һ������ʹ�õ���Ҫ������____________ ��ͼ��ʾij�εζ�ʱ50 mL�ζ�����ǰ��Һ���λ�á��ζ��ܶ���ʱӦע��____________________________________�����첿��Ӧ____________________________����ȥ�ı�����������_____________mL

��2����ʵ��Ӧѡ��_____��ָʾ�������������ȷ���յ㣿______________________________��
��3�����������ּٶ�����������ۣ�(���Ӱ�족����ƫ�ߡ�����ƫ�͡�)
a�����ζ�ǰ������ˮ��ϴ��ƿ�����ʹ�ⶨ���__________��
b�����ڵζ������в�����������Һ������ƿ�⣬���ʹ�ⶨ���__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com