
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL

(2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
【答案】酸 容量瓶 读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL。 充满溶液,无气泡 24.60 酚酞 滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色 无影响 偏高
【解析】
(1)根据酸性溶液存放在酸式滴定管中;根据滴定管的结构以及测量体积的原理来分析;
(2)NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择碱性变色范围内的指示剂酚酞;
(3)根据c(待测)=c(标准)V(标准)/V(待测)分析误差。
盐酸是酸性溶液,存放在酸式滴定管中;配制cmol/L盐酸标准液,必须使用的主要容器是容量瓶;滴定前读数为:0.30mL,滴定后读数为:24.90mL,消耗溶液的体积为24.60mL;滴定管读数时应注意读数时,眼睛应平视液体凹液面的最低点,读数应到0.01mL;尖嘴部分应充满溶液,无气泡;故答案为:酸;容量瓶;读数时,眼睛应平视液体凹液面的最低点,读数应到0.01mL;充满溶液,无气泡;24.60mL。
(2)该滴定实验是用酸滴定未知浓度的碱,所以应选用的指示剂为酚酞;确定终点的方法为滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色,故答案为:酚酞,滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色。
(3)a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)V(标准)/V(待测)分析,可知c(标准)无影响,故答案为:无影响。
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=c(标准)V(标准)/V(待测)分析,可知c(标准)偏高,故答案为:偏高。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
回答如下问题:

(1)0→t2时间段内反应速率增大的原因是: _________________________________ ,
(2)t2→t时间段内反应速率减小的原因是: _______________ ,
(3)图中阴影部分“面积”表示t1→t3时间里________ 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L![]() 中含有的极性键数目为0.2
中含有的极性键数目为0.2![]()
B. 13.8g![]() 和
和![]() 的混合气体与足量水反应,转移的电子数为0.2
的混合气体与足量水反应,转移的电子数为0.2![]()
C. 足量铜与含0.2mol![]() 的浓硫酸反应,生成
的浓硫酸反应,生成![]() 分子数为0.1
分子数为0.1![]()
D. 常温下,pH均为4的![]() 溶液和
溶液和![]() 溶液各1L,水电离出的
溶液各1L,水电离出的![]() 数目均为
数目均为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质间有着一定的转化关系,下列各组物质间可以按下图所示直接转化的是

A.Na→Na2O→Na2CO3→Na2O2B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOHD.HCl→CuCl2→BaCl2→HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
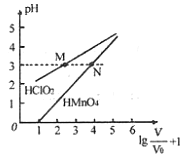
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com