
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
【答案】A
【解析】
由信息可知,该反应为气体体积增大、且吸热的反应,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,判定平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,以此来解答。
A、烧瓶内气体的质量一直不随时间的变化而变化,不能说明达平衡状态,选项A错误;B、烧瓶内气体的颜色不再加深,说明二氧化氮的浓度不变,反应达平衡状态,选项B正确;C、烧瓶内气体的压强不再变化,说明气体的物质的量不变,反应达平衡状态,选项C正确;D、N2O4的消耗速率与NO2的消耗速率之比为1:2,可知NO2的生成速率与NO2消耗速率相等,反应达平衡状态,选项D正确;答案选A。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )

A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的5种主族元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子电子层数之和是5;B原子的最外层电子数是其电子层数的2倍;D的一种单质是一种有特殊臭味的淡蓝色气体,可用于杀菌消毒;E与A在同一主族。
请回答下列问题:
(1)A与E可形成化合物甲,甲与水反应可生成H2,写出甲的电子式:__________________。
(2)甲与AlCl3反应得到NaAlH4,甲与NaAlH4都是重要的还原剂,写出NaAlH4与水发生反应的化学方程式:____________________________________。
(3)某同学认为;用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与E的单质反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2;即可证明得到的甲一定是纯净的。判断该同学设想的制备和验纯方法的合理性并说明理由:____________________________________。
(4)C元素的气态氢化物也具有一定的还原性,写出其与CuO反应的化学力程式:____________________________________。
(5)B、D、E组成的一种盐中,B的质量分数为17.91%,其水溶液能使酸性高锰酸钾溶液褪色,写出该盐的化学式:_______________。常温下,该盐的水溶液中离子浓度由大到小的顺序为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键和共价键的断裂和形成的是
A. 2H2+O2![]() 2H2O B. NH3+HCl=NH4Cl
2H2O B. NH3+HCl=NH4Cl
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Mg+CO2![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物M由两种常见的元素组成,为了测定其组成进行如下实验:
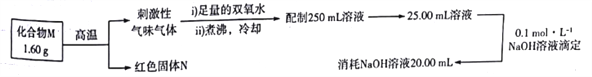
M的化学式可能为( )
A. Cu2S B. CuS C. FeS2 D. Fe3S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:
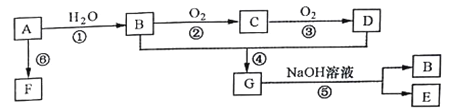
(1)A的结构式为________。
(2)D中含氧原子团的名称为_____,④的化学反应类型为_______。
(3)请分别写出⑤、⑥的化学方程式__________、_________。
(4)在实验室中,可用下图所示装置制取少量G,试管a中盛放的试剂是____,其作用为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):
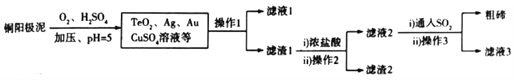
①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com