
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
【答案】B
【解析】
A选项,PCl3反应在前50 s的平均反应速率为![]() ,故A错误;
,故A错误;
B选项,相同温度下,原反应达到平衡时n(PCl3) = 0.4mol,n(Cl2) = 0.4mol,n(PCl5) = 1.6mol,平衡常数 ,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,
,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,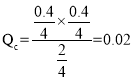 ,因此正向移动,达到平衡前v(正)>v(逆),故B正确;
,因此正向移动,达到平衡前v(正)>v(逆),故B正确;
C选项,相同温度下,起始时向该容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,与原平衡达到等效平衡,此时PCl3的转化率等于80%,而容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,相当于两个容器再加压,平衡向生成PCl5的方向移动,因此PCl3的转化率大于80%,故C错误;
D选项,原平衡的c(PCl3)=0.10 mol/L,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,平衡正向移动,升温向吸热反应移动,即正向是吸热反应,则反应的ΔH>0,故D错误。
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是
A.若2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则1mol碳完全燃烧放出的热量大于110.5kJ
B.若CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-812.3kJ/mol,则甲烷的燃烧热为812.3kJ/mol
C.若2NO2(g)![]() N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
D.若H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,含1 mol CH3COOH的溶液与含1molNaOH的溶液混合,放出热量为57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关方程式或离子方程式正确的是
A.碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3 H2O![]() Fe(OH)3(胶体)+3 H+
Fe(OH)3(胶体)+3 H+
C.泡沫灭火器原理可表示为:2Al3++3CO32-+3 H2O=2Al(OH)3↓+3CO2↑
D.NaClO溶液呈碱性:ClO—+H2O![]() HClO+OH-
HClO+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大
B.0.1 mol·L-1的醋酸溶液,由水电离出来的c(H+)=1.0×10-13 mol·L-1
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
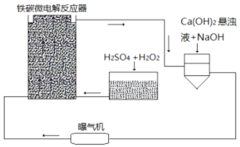
【题目】铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示。
请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为______,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为:______。
(2)其治理污水原理主要有以下几个方面:
①一些不活泼的重金属离子被Fe置换出来。写出从![]() 中置换金的离子方程式______。
中置换金的离子方程式______。
②在处理过程中,有些胶体会发生电泳,向某极富集,从而聚沉除去。![]() 胶体电泳时,会向______极移动。
胶体电泳时,会向______极移动。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
A.都有还原性![]() 表面积都很大
表面积都很大![]() 都含金属元素
都含金属元素![]() 都是胶体
都是胶体
④过程中产生的![]() 能沉淀或结合一些无机阴离子
能沉淀或结合一些无机阴离子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制备
。由FeS制备![]() 气体可选用______。
气体可选用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀盐酸
稀盐酸![]() 浓硫酸
浓硫酸
(3)溶液中的Fe元素最终均转化为![]() 沉淀除去。为更好除去
沉淀除去。为更好除去![]() 和
和![]() ,请参考装置图,从试剂用量角度提出可以采取哪些措施
,请参考装置图,从试剂用量角度提出可以采取哪些措施![]() 回答一条即可
回答一条即可![]() ______。
______。
(4)已知常温下,![]() ;
;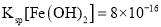 。
。
①计算![]() 的水解常数为______。
的水解常数为______。
②向饱和![]() 、
、![]() 混合溶液中,逐渐加入少量固体
混合溶液中,逐渐加入少量固体![]() 忽略体积和温度变化
忽略体积和温度变化![]() ,
,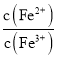 会______,
会______,![]() 选填“逐渐增大”、“逐渐减小”、“不变”
选填“逐渐增大”、“逐渐减小”、“不变”![]() 。结合相关数据推理说明原因______。
。结合相关数据推理说明原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A. 常温下,11.2LSO2含有的氧原子数小于NA
B. 0. 1molNa2O2和Na2O的混合物中含有的离子总数等于0.4NA
C. 10g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D. 100mL0.lmol/L醋酸中含有的醋酸分子数是0.0lNA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com