
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
【答案】C
【解析】
A.存在平衡:2CrO42-(aq,黄色)+2H+(aq)![]() Cr2O72-(aq,橙色)+H2O(l),如颜色不变,说明浓度不变,则达到平衡状态,A正确;
Cr2O72-(aq,橙色)+H2O(l),如颜色不变,说明浓度不变,则达到平衡状态,A正确;
B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,设需要x mol FeSO4·7H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),解得x=1.65,m(FeSO47H2O)=1.65mol×278g/mol=458.7g,B正确;
C.转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)=28.6g÷52g/mol=0.55mol,CrO42-有10/11转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-10/11)=0.05mol/L,c(Cr2O72-)=0.55mol/L×10/11×1/2=0.25mol/L,由题中信息可知,常温下转换反应的平衡常数K=1×1014,则c(Cr2O72-)/c2(CrO42-)c2(H+)=1×1014,解得c(H+)=1×10-6mol/L,所以pH=6,C错误;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,则c(Cr3+)×c3(OH-)=1×10-32,解得c(OH-)=1×10-9mol/L,pH=5,D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
II. 在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(3)乙酸分子中官能团的名称分别是_______。
(4)试管a中发生反应的化学方程式为______________;
反应类型是__________。
(5)反应开始前,试管b中盛放的溶液是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A.①④⑤B.②⑦C.⑤⑥⑧D.④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
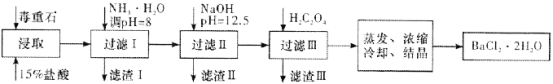
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
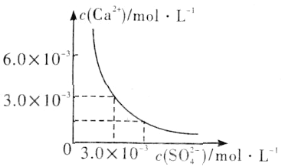
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列前者是后者4倍的是( )
①核外电子数 ②最外层电子数 ③电子层数 ④次外层电子数
A.①④B.①③④C.①②④.D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 mL一定物质的量浓度的盐酸被一定物质的量浓度的NaOH溶液滴定的图示如下图,据图推出NaOH溶液和盐酸的物质的量浓度正确的是

A | B | C | D | |
c(HCl) | 0.12 | 0.04 | 0.12 | 0.09 |
c(NaOH) | 0.04 | 0.12 | 0.06 | 0.03 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com