
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
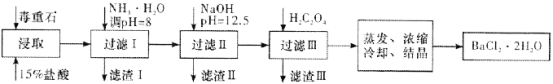
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
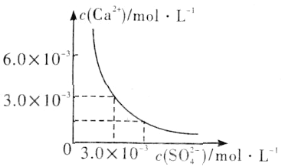
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
【答案】Mg3(PO4)2 <10-4mol·L-1可以增大反应物的接触面积,增大反应速率Fe3+Mg(OH)2、Ca(OH)2会导致生成BaC2O4沉淀,产品产量会减少D
【解析】
(1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中c(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为![]() ,所以溶液中c(Ca2+)=
,所以溶液中c(Ca2+)=![]() ,即当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度<10-4mol·L-1;
,即当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度<10-4mol·L-1;
(2)①化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率;
②根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.7,加入氨水,调pH为8,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少;
(3)由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c(SO42-)=3.0×10-3 mol/L,Ksp(CaSO4)=9.0×10-6。向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1Na2SO4溶液后,混合液中c(Ca2+)=0.1L×3.0×103mol/L/(0.1L+0.4L)=6.0×10-4 mol/L,c(SO42-)=(0.1L×3.0×103mol/L+0.4L×0.01mol/L)/(0.1L+0.4L)=8.6×10-3 mol/L,溶液中c(Ca2+)·c(SO42-)=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出,最终溶液中硫酸根离子浓度增大,答案选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是__________;实验室在配制FeSO4溶液时常加入____以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化__。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是______________________。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是_____________________________。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为_。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________ (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机化合物转化关系如下图(部分反应条件已略去)。
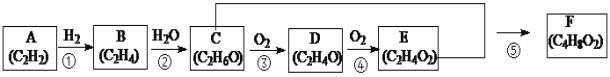
(1)A的结构式为_____;C中官能团的名称为_____;D物质的名称为_____。
(2)属于取代反应的有_____(填序号)。
(3)A光照生成G(分子式为C6H6),G分子中所有原子在同一平面,G既不能使酸性高锰酸钾溶液反应褪色,也不能使溴水反应褪色,则G的结构简式为_____。
(4)H是E的同分异构体,能发生水解反应,H的结构简式可能为_____。
(5)反应③的化学方程式为_____;反应⑤的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:![]()
B. 甲烷分子的比例模型: ![]()
C. COCl2的结构式为:![]()
D. H2O2的电子式为:H+[ ![]() ]2-H+
]2-H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
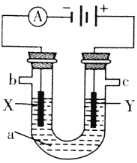
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中在X极附近观察到的现象是________。
②检验Y电极上电极反应产物的方法是________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①Y电极的材料是_______,电极反应式是_____。(说明:杂质发生的电极反应不必写出)
②当电路中有0.04mol电子通过时,阴极增重________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,合成氨反应N2 + 3H2 ![]() 2NH3的微观历程如下图所示。用
2NH3的微观历程如下图所示。用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
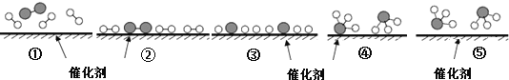
A. ①→② 催化剂在吸附N2、H2时,形成新的化学键
B. ②→③ 形成N原子和H原子是放热过程
C. ①→⑤ N2和H2全部化合成氨气
D. 使用合适的催化剂,能提高合成氨反应的效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验2中,在5~10 min内,以物质A表示的平均反应速率为______mol·L-1·min-l,25 min时,v(正)______(填“<”、“>”或“=”)v(逆)。
(2)0~10 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是______。
(3)实验3的探究目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作或现象能达到预期实验目的的是
选项 | 操作或现象 | 实验目的 |
A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com