
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验2中,在5~10 min内,以物质A表示的平均反应速率为______mol·L-1·min-l,25 min时,v(正)______(填“<”、“>”或“=”)v(逆)。
(2)0~10 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是______。
(3)实验3的探究目的是______。
【答案】0.020 = 快 实验2中使用了催化剂 探究温度对速率的影响
【解析】
(1)根据平均化学反应速率公式计算;根据表中数据25 min时达到平衡状态,v(正)=v(逆);
(2)实验1、2起始量相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快;
(3)根据图表可以知道,实验1、3起始量相同,实验3温度比实验1高。
(1)实验2中,在5~10 min内,以物质A表示的平均反应速率为v(A)=![]() =
=![]() =0.020mol·L-1·min-l;根据表中数据可以知道,20min以后A的浓度不再变化,说明20min后达到平衡状态,则25min时,v(正)=(逆),故答案为:0.020,=。
=0.020mol·L-1·min-l;根据表中数据可以知道,20min以后A的浓度不再变化,说明20min后达到平衡状态,则25min时,v(正)=(逆),故答案为:0.020,=。
(2)实验1、2起始量相同,温度相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快,说明加入了催化剂,加快反应速率,平衡不变,故答案为:快,实验2中使用了催化剂。
(3)根据图表可以知道,实验1、3起始量相同,但实验3温度比实验1高,实验3达到平衡所需要的时间短,反应速率增大,所以实验3的探究目的是探究温度对速率的影响,故答案为:探究温度对速率的影响。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
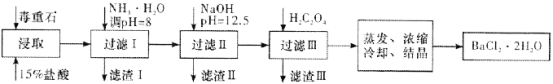
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
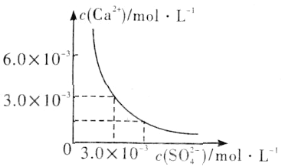
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源—锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
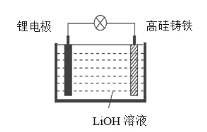
A. 高硅铸铁发生氧化反应B. OH-向高硅铸铁电极移动
C. 负极的电极反应式为Li-e-![]() Li+D. 电流的方向:锂电极→导线→钢电极
Li+D. 电流的方向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列前者是后者4倍的是( )
①核外电子数 ②最外层电子数 ③电子层数 ④次外层电子数
A.①④B.①③④C.①②④.D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 2.0mol/L的盐酸中Cl—的物质的量为( )
A. 2.0mol B. 0.20mol C. 1.0mol D. 0.10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 + 4H2![]() CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
A. 适当升温能加快反应速率B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0D. 达到平衡时,CO2能100%转化为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于可逆反应的是( )
A.Cl2溶于水
B.SO2与O2反应生成SO3
C.NH3溶于水
D.水电解生成H2和O2与H2在O2中燃烧生成水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com