
【题目】CO2 + 4H2![]() CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
A. 适当升温能加快反应速率B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0D. 达到平衡时,CO2能100%转化为CH4
科目:高中化学 来源: 题型:
【题目】常见有机化合物转化关系如下图(部分反应条件已略去)。
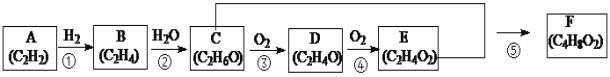
(1)A的结构式为_____;C中官能团的名称为_____;D物质的名称为_____。
(2)属于取代反应的有_____(填序号)。
(3)A光照生成G(分子式为C6H6),G分子中所有原子在同一平面,G既不能使酸性高锰酸钾溶液反应褪色,也不能使溴水反应褪色,则G的结构简式为_____。
(4)H是E的同分异构体,能发生水解反应,H的结构简式可能为_____。
(5)反应③的化学方程式为_____;反应⑤的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,合成氨反应N2 + 3H2 ![]() 2NH3的微观历程如下图所示。用
2NH3的微观历程如下图所示。用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
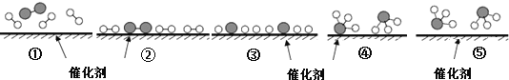
A. ①→② 催化剂在吸附N2、H2时,形成新的化学键
B. ②→③ 形成N原子和H原子是放热过程
C. ①→⑤ N2和H2全部化合成氨气
D. 使用合适的催化剂,能提高合成氨反应的效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验2中,在5~10 min内,以物质A表示的平均反应速率为______mol·L-1·min-l,25 min时,v(正)______(填“<”、“>”或“=”)v(逆)。
(2)0~10 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是______。
(3)实验3的探究目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极; ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D![]() 导线
导线![]() C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是 ( )
C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是 ( )
A. A> B > C > D B. A > C > D > B
C. C > A > D > B D. C > B > D > A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的分子式为C4H8O2,它与NaOH溶液发生反应的产物有如下转化关系。

下列说法不正确的是( )
A. A结构简式为CH3COOCH2CH3
B. E的分子式为C2H6O
C. A在NaOH溶液中发生取代反应
D. C滴入NaHCO3溶液中有气泡生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作或现象能达到预期实验目的的是
选项 | 操作或现象 | 实验目的 |
A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

回答下列问题:.
(1)固体1含有的物质是_________、CaCO3、Ca(OH)2;捕获剂所捕获的气体主要是_______________。
(2)若X是空气,则上述反应中NO和O2的物质的量之比最好为___________,若空气过量,导致的结果会是____________________________。
(3)流程中处理含NH4+废水时发生反应的离子方程式为____________________________。气体1也可通过催化剂直接转化成无污染气体,反应的化学方程式为_____________________________________。
(4)若工业废气中主要含N2、SO2,不考虑其他成分,则可用下列工艺生产NaHSO3过饱和溶液[NaHSO3过饱和溶液是生产焦亚硫酸钠(Na2S2O5)的原料]。
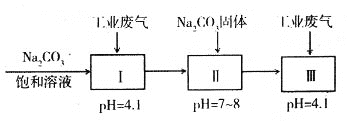
pH=4.1时,I中反应的化学方程式为_________________________;工艺中加入Na2CO3
固体、并再次通入废气的目的是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com