
【题目】工业上,合成氨反应N2 + 3H2 ![]() 2NH3的微观历程如下图所示。用
2NH3的微观历程如下图所示。用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
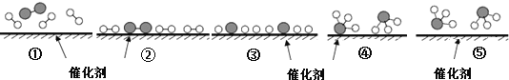
A. ①→② 催化剂在吸附N2、H2时,形成新的化学键
B. ②→③ 形成N原子和H原子是放热过程
C. ①→⑤ N2和H2全部化合成氨气
D. 使用合适的催化剂,能提高合成氨反应的效率
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
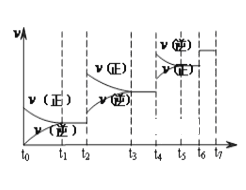
(1)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是______________________;图中表示平衡混合物中CO的含量最高的一段时间是____________。
(2)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是__________________ (提示:272 = 729)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A.①④⑤B.②⑦C.⑤⑥⑧D.④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
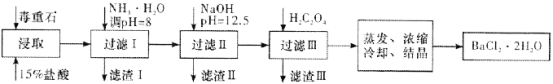
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
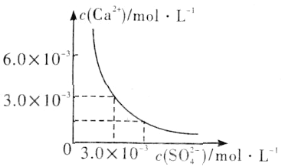
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源—锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
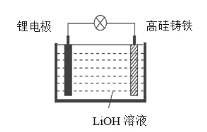
A. 高硅铸铁发生氧化反应B. OH-向高硅铸铁电极移动
C. 负极的电极反应式为Li-e-![]() Li+D. 电流的方向:锂电极→导线→钢电极
Li+D. 电流的方向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列前者是后者4倍的是( )
①核外电子数 ②最外层电子数 ③电子层数 ④次外层电子数
A.①④B.①③④C.①②④.D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 + 4H2![]() CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
A. 适当升温能加快反应速率B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0D. 达到平衡时,CO2能100%转化为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com