
【题目】常见有机化合物转化关系如下图(部分反应条件已略去)。
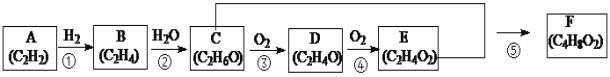
(1)A的结构式为_____;C中官能团的名称为_____;D物质的名称为_____。
(2)属于取代反应的有_____(填序号)。
(3)A光照生成G(分子式为C6H6),G分子中所有原子在同一平面,G既不能使酸性高锰酸钾溶液反应褪色,也不能使溴水反应褪色,则G的结构简式为_____。
(4)H是E的同分异构体,能发生水解反应,H的结构简式可能为_____。
(5)反应③的化学方程式为_____;反应⑤的化学方程式为_____。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
阴离子 | OH- Cl- CO32- NO3- SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A______________;C______________。
(2)写出步骤②中发生反应的化学方程式____________________________________。
(3)D溶液中滴入石蕊试液,现象是___________________________________________,原因是_____________________________________________(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是____________mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为_________________________________。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。_________
 ’。
’。
查看答案和解析>>
科目:高中化学 来源: 题型:
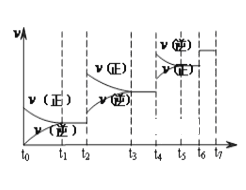
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是______________________;图中表示平衡混合物中CO的含量最高的一段时间是____________。
(2)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是__________________ (提示:272 = 729)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
II. 在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(3)乙酸分子中官能团的名称分别是_______。
(4)试管a中发生反应的化学方程式为______________;
反应类型是__________。
(5)反应开始前,试管b中盛放的溶液是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[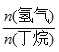 ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
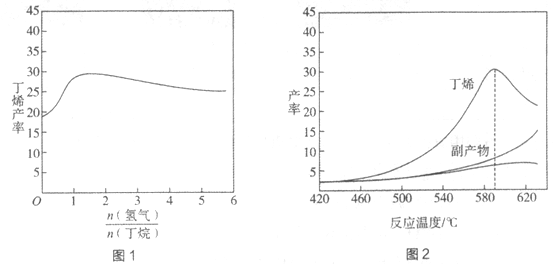
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[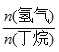 ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A.①④⑤B.②⑦C.⑤⑥⑧D.④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
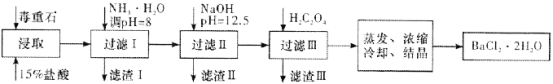
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
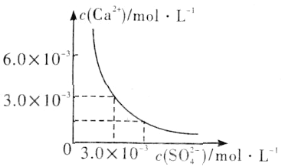
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 + 4H2![]() CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是
A. 适当升温能加快反应速率B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0D. 达到平衡时,CO2能100%转化为CH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com