
����Ŀ��ˮ��Һ�д��ڶ���ƽ�⣬�������ѧ��ѧ֪ʶ�ش��������⣺
��1����Ũ�Ⱦ�Ϊ0.1mol/L��CH3COONH4 ��NH4HSO4 ��NH3.H2O ��(NH4)2SO4��Һ�У�NH4+Ũ���ɴ�С��˳��Ϊ������ţ�___��
��2��Ũ�Ⱦ�Ϊ0.1mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ��������Һ�е�H��Ũ���ɴ�С��˳����(�����)___��
��3�������£���pH=6������ˮ�м���2.3g�����ƣ���ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=___��
��4����FeCl3��NaHCO3��K2SO3��Һ���ɡ����պ�õ��Ĺ������ʷֱ���___��
���𰸡���>��>��>�� ��>��>��>�� 11 Fe2O3��Na2CO3��K2SO4
��������
��1����NH3H2O��Һ��NH3H2O���ֵ��룬c��NH4+����С����������ϵ����ˮ��̶ȿ����жϣ�
��2������Һ�м��������������H2O�ĵ��룬����Һ��H+��OH-Ũ��Խ����ˮ�������H+Ũ��ԽС���ε�ˮ���ܴٽ�ˮ�ĵ��룻
��3�������£�pH=6������ˮ��Kw=c��H+����c��OH-��=��10-6��2=10-12�������Һ����������Ũ�ȼ��ɣ�
��4����FeCl3��Һ����ʱ��������ˮ������Fe��OH��3��HCl�������¶�����������ֽ���Ǻ���ɫ����Fe2O3��̼�����Ʋ��ȶ����������ֽ�����̼���ƺ�ˮ��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4��
��1����NH3H2O��Һ��c��NH4+��С����ε�c��NH4+��������һˮ�ϰ���Һ��笠�����Ũ����С������笠�����ϵ����2���٢���笠�����ϵ������1�����ԢܱȢ٢ڵĴ�������������笠�����ˮ�⣬����笠������ѶȢڣ��٣�����NH4+Ũ���ɴ�С��˳��Ϊ���ܣ��ڣ��٣��ۣ��ʴ�Ϊ���ܣ��ڣ��٣��ۣ�
��2������Һ�м��������������H2O�ĵ��룬����Һ��H+��OH-Ũ��Խ����ˮ�������H+Ũ��ԽС���ε�ˮ���ܴٽ�ˮ�ĵ��룬������ˮ�����c��H+���ɴ�С��˳��Ϊ���ܢڢۢ٣��ʴ�Ϊ���ܣ��ڣ��ۣ��٣�
��3�������£�pH=6������ˮ��Kw=c��H+����c��OH-��=��10-6��2=10-12��2.3g�����Ƶ����ʵ���n= ![]() =
= ![]() =0.1mol��c��OH-��=c��NaOH��=
=0.1mol��c��OH-��=c��NaOH��= ![]() =0.1mol/L��c��H+��=
=0.1mol/L��c��H+��= ![]() =10-11mol/L��������Һ��pH=11���ʴ�Ϊ��11��
=10-11mol/L��������Һ��pH=11���ʴ�Ϊ��11��
��4����FeCl3��Һ����ʱ��������ˮ������Fe��OH��3��HCl�������¶ȴٽ�HCl�ӷ�������������Һʱ�õ��������������ʱ������������ֽ���Ǻ���ɫ����Fe2O3����Ϊ̼�����Ʋ��ȶ����������ֽ�����̼���ƺ�ˮ����ѧ����ʽΪ��2NaHCO3 ![]() Na2CO3+CO2��+H2O������NaHCO3ˮ��Һ���ɲ����գ��õ���������Na2CO3��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4�����õ��IJ���Ӧ����K2SO4��
Na2CO3+CO2��+H2O������NaHCO3ˮ��Һ���ɲ����գ��õ���������Na2CO3��K2SO3���н�ǿ��ԭ�ԣ������ɵ�ʱ�����ױ������е���������������K2SO4�����õ��IJ���Ӧ����K2SO4��


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2(g)��B2(g)![]() 2C(g)��H=��a kJ/mol(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ�ﵽƽ���C��Ũ��Ϊwmol��L��1���ų�����bkJ��
2C(g)��H=��a kJ/mol(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ�ﵽƽ���C��Ũ��Ϊwmol��L��1���ų�����bkJ��
��1��a________b(����>������������<��)��
��2���÷�Ӧ��ƽ�ⳣ������ʽΪ________��������Ӧ�¶����ߵ�700 �����÷�Ӧ��ƽ�ⳣ����________(��������������С������������)��
��3����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________��
a��v(C)��2v(B2) b��������ѹǿ���ֲ��� c��v��(A2)��2v��(B2) d�������ڵ��ܶȱ��ֲ���
��4��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ��IJ�����________��
a����ʱ�����C���� b���ʵ������¶� c������B2��Ũ�� d��ѡ���Ч�Ĵ���
��5���ܱ������У���һ����̼��ˮ����������������ȣ��ڴ��������·�����Ӧ��CO(g)��H2O(g)![]() H2(g)��CO2(g)����500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ________��
H2(g)��CO2(g)����500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У���ش��������⣺
��1��NH4Al(SO4)2������ˮ������ԭ����_____________________________________�����������ӷ���ʽ�����ֽ���������
��2����ͬ�����£�0.1molL��1NH4Al(SO4)2��c(NH4+)________________��������������������������С������0.1molL��1 NH4HCO3��c(NH4+)��
��3����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ��
�����з���0.1molL��1NH4Al(SO4)2��pH���¶ȱ仯��������__________����д��ţ���
��25��ʱ��0.1molL��1NH4Al(SO4)2��2c(SO42��)��c(NH4+)��3c(Al3+)=__________________ molL��1��д����ȷ�������
��4������ʱ����100mL 0.1molL��1 NH4HSO4��Һ�еμ�0.1molL��1 NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ2��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������__________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����______________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������У�����֤������������ʵ��ǣ� ��
![]() ��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��
��С��ͬ����Ƭ��pH��ͬ����ʹ��ᷴӦ���տ�ʼʱ������������H2������ͬ��������ʱ��0.1mol/L������Һ��pHԼΪ3����10mL1mol/L����ǡ����10mL1mol/LNaOH��Һ��ȫ��Ӧ���ܳ����£���ô�������Һ��pH>7��![]() ������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
������Һ�ĵ����Ա�������Һ�����������£���pH=1�Ĵ��������ϡ����ͬ�ı���������ô����pH�仯��С��
A.�ڢܢݢ�B.�ڢܢ�C.�٢ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(BCl3)��һ����Ҫ�Ļ���ԭ�ϡ�ʵ�����Ʊ�BCl3��ԭ��B2O3+3C+3Cl2 =2BCl3+3CO��ijʵ��С�����ø��������������װ�ã�װ�ÿ��ظ�ʹ�ã��Ʊ�BCl3����֤��Ӧ����CO���ɡ���֪��BCl3���۵�Ϊ-107.3�棬�е�Ϊ12.5�棬��ˮˮ������H3BO3��HCl����ش��������⣺
��ʵ����Ʊ�BCl3����֤����CO

(1)��ʵ��װ���к���������˳��ΪG��_____��_____��_____��____��F��D��I������װ��E��������___________________________��
(2)װ��J�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ʵ���Ʒ���Ⱥ����IJⶨ
��ȷ��ȡ����m�˲�Ʒ����������ˮ����ȫˮ�⣬�����100mL��Һ��
��ȡ10.00mL��Һ����ƿ��
�ۼ���V1mLŨ��ΪC1 mol/LAgNO3��Һʹ��������ȫ�����������м�����������������ҡ����
����������Ϊָʾ������C2 mol/L KSCN����Һ�ζ�������AgNO3��Һ��������Ӧ��Ag+ +SCN- =AgSCN����
���ظ������~�ܶ��Σ��ﵽ�ζ��յ�ʱ��ȥKSCN��Һ��ƽ�����ΪV2 mL��
��֪: Ksp(AgCl)>Ksp(AgSCN) ��
(3)������дﵽ�ζ��յ������Ϊ__________________��
(4)ʵ������м�����������Ŀ����___________________��
(5)��Ʒ����Ԫ�ص���������Ϊ_________________%��
(6)���в��������������ò�Ʒ���Ⱥ���ƫ����__________��
A.��������������
B.�����������100mL��Һʱ������ʱ���ӿ̶���
C.��KSCN��Һ�ζ�ʣ��AgNO3��Һʱ���ζ�ǰ�����ݣ��ζ���������
D.�ζ�ʣ��AgNO3��Һʱ��KSCN��Һ�ε���ƿ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵��ǣ� ��

ѡ�� | �� | �� | �� | ʵ����� |
A | ϡ���� | CaCO3 | Na2SiO3��Һ | �ǽ�����:Cl>C>Si |
B | Ũ���� | ���� | Ba(NO3)2��Һ | ��֤SO2������Ա��ο����ɰ�ɫ���� |
C | Ũ��ˮ | ��ʯ�� | ��̪��Һ | ������ˮ��Һ�ʼ��� |
D | Ũ���� | Fe | NaOH��Һ | ����Ũ���ᷴӦ������NO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯���(LiAlH4)���л��ϳ��е���Ҫ��ԭ����ij���������ʵ���Ʊ��⻯��﮲��ⶨ�䴿�ȡ���֪: �⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ������ͬһ�����塣
I.�Ʊ��⻯�
ѡ��ͼI�е�װ���Ʊ��⻯�(��Щװ�ÿ��ظ�ʹ��):
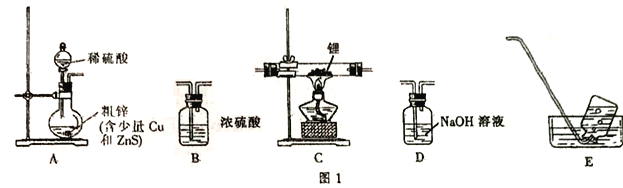
��1��װ�õ�����˳��(��������)ΪA��______________��
��2�����ں�װ��װ�õ������ԣ���ȼ�ƾ���ǰ����е�ʵ�������_______________��
��3��д���Ʊ��⻯��﮵Ļ�ѧ����ʽ:__________________��
II. �Ʊ��⻯���
1947����Schlesinger,Bond��Finholt�״��Ƶ��⻯��ﮣ��䷽����ʹ�⻯�����ˮ���Ȼ�����һ�������������л������������ַ�Ӧ������һϵ�в����õ�LiAlH4���塣
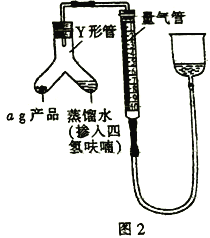
��4��д���⻯�����ˮ���Ȼ�����Ӧ�Ļ�ѧ����ʽ:____________________��
III.�ⶨ�⻯��﮲�Ʒ(�����⻯�)�Ĵ���
��5����ͼ2װ�����������װ�������Բ�װ��ҩƷ(Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ�),������Ӧ�IJ�����________������֮ǰ�����ƶ��������Ҳ��������ʹ�����������������Һ����ͬһˮƽ���ϣ���Ŀ����_________��
��6���ڱ�״���£���Ӧǰ�����ܶ���ΪV1mL����Ӧ��ϲ���ȴ֮�������ܶ���ΪV2mL������Ʒ�Ĵ���Ϊ_____________(�ú�a��V1��V2�Ĵ���ʽ��ʾ)�������ʼ����ʱ���ӿ̶�������õĽ����________(�ƫ������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯��ҲҪ��ע��Ӧ�Ŀ������ȡ��ش��������⣺
I.���з�Ӧ����![]() ����
����![]() ��
��
(1)����Ӧ���������ȷ�Ӧ����______![]() �����
�����![]() ��
��
(2)![]() ԭ��ص�װ����ͼ��ʾ��
ԭ��ص�װ����ͼ��ʾ��

����Һ��![]() ��______
��______![]() ������������ͭ��
������������ͭ��![]() �缫�����ƶ���
�缫�����ƶ���
��������������______�������ĵ缫��ӦʽΪ______��
![]() ij���淴Ӧ��
ij���淴Ӧ��![]() ��3�ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A��Ũ���淴Ӧʱ��ı仯������±���
��3�ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A��Ũ���淴Ӧʱ��ı仯������±���
ʵ����� | ʱ�� Ũ�� �¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 |
|
|
|
|
|
| |
2 | 800 |
|
|
|
|
|
|
|
3 | 950 |
|
|
|
|
|
|
|
(3)ʵ��1�У���![]() min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ______
min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ______![]() ��50minʱ��
��50minʱ��![]() ��
��![]() ______
______![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��![]() ��
��
(4)0��20min�ڣ�ʵ��2��ʵ��1�ķ�Ӧ����______![]() ����������������
����������������![]() ����ԭ�������______��
����ԭ�������______��
(5)ʵ��3��ʵ��1�ķ�Ӧ���ʿ죬��ԭ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com