
����Ŀ���������Ʊ���������Ʒ��ɫ�����������ȣ�������������Ʒ�ӹ�������ɫ����������������ʳƷ���Ӽ��м��Զ��Խ�ǿ������֮һ����һ�־綾ҩ����ȡ�����������ν���ѪҺ��ʹ������Ѫ�쵰�ױ������Ѫ�쵰��ʧȥЯ�����Ĺ��ܣ�������֯ȱ���������ƵĶ���������Ҫ����������ʳ���С���ˮ�л���θ�����ڱ���ԭ�������������¡����������������������������������еĵ�����������![]() ��
��![]() ���������ƻ�̼������Һ�����Ƶá������Ƶ����������ǽ����������е�β���ü�Һ���պ�����ת�������ü��к͡��������ᾧ�������Ƶá�
���������ƻ�̼������Һ�����Ƶá������Ƶ����������ǽ����������е�β���ü�Һ���պ�����ת�������ü��к͡��������ᾧ�������Ƶá�
![]() ʵ���ҿ��ü��������������Ȼ�淋�Ũ��Һ��ȡ������д���÷�Ӧ�Ļ�ѧ����ʽ��______ ��������������Һ�μӵ������۵�����KI��Һ�У��ɹ۲쵽��Һ����ɫ��д���÷�Ӧ�����ӷ���ʽ��______ ��������������Һ�μӵ�
ʵ���ҿ��ü��������������Ȼ�淋�Ũ��Һ��ȡ������д���÷�Ӧ�Ļ�ѧ����ʽ��______ ��������������Һ�μӵ������۵�����KI��Һ�У��ɹ۲쵽��Һ����ɫ��д���÷�Ӧ�����ӷ���ʽ��______ ��������������Һ�μӵ�![]() ������Һ�У��ɹ۲쵽��Һ����ɫ�� ______ ɫ��Ϊ��ɫ��д���÷�Ӧ�����ӷ���ʽ��______ ��
������Һ�У��ɹ۲쵽��Һ����ɫ�� ______ ɫ��Ϊ��ɫ��д���÷�Ӧ�����ӷ���ʽ��______ ��
![]() ���������
���������![]() ��
��![]() ������������Һ��Ӧ��������������Һ�����ӷ���ʽ��______ ������
������������Һ��Ӧ��������������Һ�����ӷ���ʽ��______ ������![]() ��Һ����
��Һ����![]() ������
������![]() ��
��![]() ��
��![]() ��Һ��ȫ��Ӧʱת�Ƶ���
��Һ��ȫ��Ӧʱת�Ƶ���![]() ����Ӧ�����ӷ���ʽΪ ______ ��
����Ӧ�����ӷ���ʽΪ ______ ��
![]() �������Լ���ѡ�ò����Լ������������ơ������ƺ��Ȼ���������ɫ��Һ�������� ______ ��
�������Լ���ѡ�ò����Լ������������ơ������ƺ��Ȼ���������ɫ��Һ�������� ______ ��
A.ϡ����![]() ��Һ
��Һ![]() ϡ����
ϡ����![]() ����������Һ
����������Һ
![]() �����ʵ���Ũ�ȵ��������ơ��Ȼ��ơ�̼����������Һ����������Ũ���ɴ�С��˳���� ______
�����ʵ���Ũ�ȵ��������ơ��Ȼ��ơ�̼����������Һ����������Ũ���ɴ�С��˳���� ______ ![]() ����Һ�����ʵĻ�ѧʽ
����Һ�����ʵĻ�ѧʽ![]() ��
��
![]() ��ҵƷ�����ƺ���������
��ҵƷ�����ƺ���������![]() ��
��![]() ��NaCl��ˮ������
��NaCl��ˮ������![]() ��ijͬѧ���ⶨ��ҵƷ�����ƵĴ��ȣ�����������ʵ�飺
��ijͬѧ���ⶨ��ҵƷ�����ƵĴ��ȣ�����������ʵ�飺
![]() ��ȡ
��ȡ![]() ���﹤ҵƷ�����ƣ�Ͷ��ʢ��������ˮ���ձ��У���ֽ�������10mL
���﹤ҵƷ�����ƣ�Ͷ��ʢ��������ˮ���ձ��У���ֽ�������10mL![]() ��A��Һ
��A��Һ![]() ����
����![]() ����ַ�Ӧ����ˣ�
����ַ�Ӧ����ˣ�
![]() ����Һ�м�������KI��Һ������ϡ���ᣬ��ַ�Ӧ��������Һ���1000mL��Һ��
����Һ�м�������KI��Һ������ϡ���ᣬ��ַ�Ӧ��������Һ���1000mL��Һ��
![]() ȡ
ȡ![]() ������Һ����ƿ�У���������B���ʣ�����
������Һ����ƿ�У���������B���ʣ�����![]() ��
��![]() ��Һ�ζ�����ȥ
��Һ�ζ�����ȥ![]() ��Һ
��Һ![]() ��
��
(�йط�ӦΪ��![]()
![]() ��Һ�е����ʵĻ�ѧʽ�� ______ ������A��Һ�������� ______ ��
��Һ�е����ʵĻ�ѧʽ�� ______ ������A��Һ�������� ______ ��
![]() ������ ______ ���ζ��յ�ʱ����ɫ�仯�� ______ ��
������ ______ ���ζ��յ�ʱ����ɫ�仯�� ______ ��
![]() ����ͬѧ������ȷ���������ɲⶨ�����ƫ�ߣ���ԭ�������
����ͬѧ������ȷ���������ɲⶨ�����ƫ�ߣ���ԭ�������![]() ��дһ��
��дһ��![]() ______ ��
______ ��
���𰸡�![]()
![]() ��
�� ![]()
![]()
![]()
![]()
![]()
![]() ʹ
ʹ![]() ��
��![]() ��
��![]() ת��Ϊ��������ȥ ���� ��ɫ
ת��Ϊ��������ȥ ���� ��ɫ![]() ��ɫ
��ɫ ![]() δ������ȫ
δ������ȫ
��������
(1)���������������Ȼ�淋�Ũ��Һ��ȡ���������ݻ��ϼ۱仯��ȼ������غ㶨����ƽ����ʽ��������������Һ�μӵ������۵�����KI��Һ�У��ɹ۲쵽��Һ����ɫ��˵�������ӱ��������������ɵⵥ�ʣ������������ƵĻ��ϼ۷�����֪�����ᷴӦ��������NO����ɫ�������ظ������Һ����ǿ�����ԣ��ܹ����������������������ƣ�ͬʱ����ԭ�ɸ����ӣ�����Һ�ɳ�ɫ��Ϊ��ɫ���ݴ�д����Ӧ�����ӷ���ʽ��
(2)��������(NO��NO2)������������Һ��Ӧ�����������ƣ����ݻ��ϼ����������ƽ��д����Ӧ����ʽ���÷�Ӧ��NO2����������NO3-������ת�Ƶĵ���������ɵ�n(NO3-)����ϻ��ϼ۵ı仯�ж���д���ӷ���ʽ��
(3)�������������������ɵ���ɫ���������Ȼ������ɲ���������İ�ɫ�������ݴ˽��н��
(4)�������ơ�NaCl��Һ�У����ݵ���غ����ε�ˮ������жϣ�̼������Һ�У�̼������Ӳ���ˮ������̼��������Ӻ����������ӣ�������Һ�е�������Ũ��������̼������Һ�е�������Ũ�ȴ���NaCl��Һ��
(5)�������ƺ���������Na2CO3��NaNO2��NaCl������A��Ŀ���dz�ȥ����CO32-��Cl-��NO2-������ѡ����������
������������������������ܹ��������������ɵⵥ�ʣ��ⵥ������������ʾ��ɫ�����õ�����ָʾ�����ζ�ǰ��ҺΪ��ɫ���ζ���������Һ��Ϊ��ɫ��
�۲ⶨ���ƫ�ߣ�˵���ⶨ�����ɵĵⵥ�����ʵ���ƫ������ĵ������������ӵ����ʵ���ƫ�ݴ˷������
![]() ���������������Ȼ�淋�Ũ��Һ��ȡ���������������е�Ԫ�صĻ��ϼ�Ϊ
���������������Ȼ�淋�Ũ��Һ��ȡ���������������е�Ԫ�صĻ��ϼ�Ϊ![]() �ۣ�笠������е�Ԫ�صĻ��ϼ�Ϊ
�ۣ�笠������е�Ԫ�صĻ��ϼ�Ϊ![]() �ۣ���Ӧ����0�۵ĵ���������ߵĻ��ϼ۱仯��ͬ����Ӧ����ʽ�ж��ߵļ�������ȣ���������غ��֪�÷�Ӧ�Ļ�ѧ����ʽΪ��
�ۣ���Ӧ����0�۵ĵ���������ߵĻ��ϼ۱仯��ͬ����Ӧ����ʽ�ж��ߵļ�������ȣ���������غ��֪�÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��������������Һ�μӵ������۵�����KI��Һ�У��ɹ۲쵽��Һ����ɫ����Ӧ�������˵ⵥ�ʣ����������ڷ�Ӧ��������������Ԫ�صĻ��ϼ۴�
��������������Һ�μӵ������۵�����KI��Һ�У��ɹ۲쵽��Һ����ɫ����Ӧ�������˵ⵥ�ʣ����������ڷ�Ӧ��������������Ԫ�صĻ��ϼ۴�![]() �۽�Ϊ
�۽�Ϊ![]() �۵�NO����Ӧ�����ӷ���ʽΪ��
�۵�NO����Ӧ�����ӷ���ʽΪ��![]() �������ظ������Һ�ܹ����������������������ƣ���Ӧ�����ӷ���ʽΪ��
�������ظ������Һ�ܹ����������������������ƣ���Ӧ�����ӷ���ʽΪ��![]() ������Һ�ɳ�ɫ��Ϊ��ɫ���ʴ�Ϊ��
������Һ�ɳ�ɫ��Ϊ��ɫ���ʴ�Ϊ��![]() ��
��![]() ���ȣ�
���ȣ�![]() ��
��
![]() ��������
��������![]() ��
��![]() ������������Һ��Ӧ�����������ƣ�NO��Ϊ
������������Һ��Ӧ�����������ƣ�NO��Ϊ![]() �۵��������ƣ����ϼ�����1�ۣ�����������
�۵��������ƣ����ϼ�����1�ۣ�����������![]() ��Ϊ
��Ϊ![]() �۵��������ƣ����ϼ۽���1�ۣ���NO��
�۵��������ƣ����ϼ۽���1�ۣ���NO��![]() �ļ�������ȣ��÷�Ӧ����ʽΪ��
�ļ�������ȣ��÷�Ӧ����ʽΪ��![]() ���������������ʵ���Ϊ��
���������������ʵ���Ϊ��![]() ���÷�Ӧ��
���÷�Ӧ��![]() ����������
����������![]() ��
��![]() ��Ӧת��
��Ӧת��![]() ���ӣ�������
���ӣ�������![]() ����ʣ��
����ʣ��![]() ������������ԭ�����������ʣ���ת��
������������ԭ�����������ʣ���ת��![]() ���ӣ�����������NԪ�ػ��ϼ�Ϊ
���ӣ�����������NԪ�ػ��ϼ�Ϊ![]() �ۣ�����������ˮ��Һ�У�Ӧ��������������ӣ���Ӧ�����ӷ���ʽΪ��
�ۣ�����������ˮ��Һ�У�Ӧ��������������ӣ���Ӧ�����ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
�� ![]() ��
��
![]() ������������������Һ��Ӧ���ɵ���ɫ�����������������Ȼ�������������Һ��Ӧ���ɲ�����ϡ����İ�ɫ����AgCl�����Լ����Լ�Ϊ��������Һ��ϡ���ᣬ��BC��ȷ���ʴ�Ϊ��BC��
������������������Һ��Ӧ���ɵ���ɫ�����������������Ȼ�������������Һ��Ӧ���ɲ�����ϡ����İ�ɫ����AgCl�����Լ����Լ�Ϊ��������Һ��ϡ���ᣬ��BC��ȷ���ʴ�Ϊ��BC��
![]() �������ơ�NaCl��Һ�У��������ܵ��Ũ��֮��=
�������ơ�NaCl��Һ�У��������ܵ��Ũ��֮��=![]() �����ݵ���غ㣬��Һ����������Ũ��
�����ݵ���غ㣬��Һ����������Ũ��![]() ����������������Һ�У�����������Ӳ���ˮ�⣬��Һ��ʾ���ԣ�������������Һ�е�������Ũ��С���Ȼ��ƣ����Ȼ�����Һ����������Ũ�ȴ����������ƣ�̼������Һ�У�̼������Ӳ���ˮ������̼��������Ӻ����������ӣ�����̼������Һ�е�������Ũ����������̼������Һ�е�������Ũ�ȴ���NaCl��Һ����������Һ��������Ũ�ȴ�СΪ��
����������������Һ�У�����������Ӳ���ˮ�⣬��Һ��ʾ���ԣ�������������Һ�е�������Ũ��С���Ȼ��ƣ����Ȼ�����Һ����������Ũ�ȴ����������ƣ�̼������Һ�У�̼������Ӳ���ˮ������̼��������Ӻ����������ӣ�����̼������Һ�е�������Ũ����������̼������Һ�е�������Ũ�ȴ���NaCl��Һ����������Һ��������Ũ�ȴ�СΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() �ձ�����������Һ�л���
�ձ�����������Һ�л���![]() ��
��![]() ��
��![]() ���ζ������л�Ӱ��ⶨ�����������Ҫ����
���ζ������л�Ӱ��ⶨ�����������Ҫ����![]() ��Һ��ʹ
��Һ��ʹ![]() ��
��![]() ��
��![]() ת��Ϊ��������ȥ���ʴ�Ϊ��
ת��Ϊ��������ȥ���ʴ�Ϊ��![]() ��ʹ
��ʹ![]() ��
��![]() ��
��![]() ת��Ϊ��������ȥ��
ת��Ϊ��������ȥ��
![]() ����Һ�м�������KI��Һ������ϡ���ᣬ��������������������¾���ǿ�����ԣ��ܹ��������������ɵⵥ�ʣ��ⵥ������������ʾ��ɫ�����Կɼ��������Ϊָʾ������Ӧ�����Һ�м�����ۺ���Һ�����ɫ���ζ�������ⵥ����ʧ����Һ�����ɫ����ζ��յ�ʱ����ɫ�仯Ϊ����ɫ
����Һ�м�������KI��Һ������ϡ���ᣬ��������������������¾���ǿ�����ԣ��ܹ��������������ɵⵥ�ʣ��ⵥ������������ʾ��ɫ�����Կɼ��������Ϊָʾ������Ӧ�����Һ�м�����ۺ���Һ�����ɫ���ζ�������ⵥ����ʧ����Һ�����ɫ����ζ��յ�ʱ����ɫ�仯Ϊ����ɫ![]() ��ɫ���ʴ�Ϊ�����ۣ���ɫ
��ɫ���ʴ�Ϊ�����ۣ���ɫ![]() ��ɫ��
��ɫ��
![]() ����ͬѧ������ȷ���������ɲⶨ�����ƫ�ߣ����������ɵĵⵥ�ʵ���ƫ�ߣ��磺
����ͬѧ������ȷ���������ɲⶨ�����ƫ�ߣ����������ɵĵⵥ�ʵ���ƫ�ߣ��磺![]() δ������ȫ���ζ������д�����������ɵ�
δ������ȫ���ζ������д�����������ɵ�![]() �������п����Dz���
����������Dz���![]() ��
��![]() ��Ӧ�����¼�����ĵⵥ�ʵ����ʵ���ƫ�ߣ�������ƫ�ߣ��ʴ�Ϊ��
��Ӧ�����¼�����ĵⵥ�ʵ����ʵ���ƫ�ߣ�������ƫ�ߣ��ʴ�Ϊ��![]() δ������ȫ
δ������ȫ![]() ��ζ������д�����������ɵ�
��ζ������д�����������ɵ�![]() ����������
����������![]() ��
��![]() ��Ӧ
��Ӧ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����̬Oԭ�Ӻ�������Ų�ʽΪ_______����̬Pԭ�Ӻ���ռ������ܼ��ĵ���������ͼΪ_________�Σ�
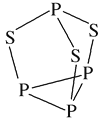
��2��P4S3����������������ӽṹ��ͼ��ʾ��P4S3��������ԭ�ӵ��ӻ��������Ϊ___________��ÿ��P4S3�����к��µ��ӶԵ���ĿΪ_______��
��3��Na��O��S�����Ӱ뾶�ɴ�С��˳��Ϊ__________
��4��SO2������ˮ����ˮ�е��ܽ��Ϊ1�����ˮ�ܽ�40�����SO2��ԭ����________��
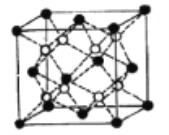
��5��Li2O�ľ�����ͼ��ʾ�����а������Li���������O������֪��������Ϊ0.4665 nm�������ӵ�������ֵΪNA����Li2O���ܶ�Ϊ______g��cm3���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ClCH=CHCl �����ֽṹ��![]() ��
��![]() ������������˫������������ת�γɵ��칹�壬��˳���칹�壬����ϩ������˳���칹�������
������������˫������������ת�γɵ��칹�壬��˳���칹�壬����ϩ������˳���칹�������
A.CH2��CH2B.CH3CH��CH2
C.CH3CH��CHCH3D.CH3CH��C(CH3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶹������ﳣ��������Ѫ˨�Լ������� 4-�ǻ��㶹�أ�X���ͱ������л���ͪ��Y����Ӧ�ɵõ������б�ͪ�㶹�أ�Z����
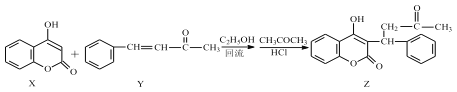
����˵����ȷ����
A.X��Y ���� Z �ķ�ӦΪ�ӳɷ�Ӧ
B.Z ����������̼ԭ�ӿ��ܹ�ƽ��
C.1mol ������ X ������� 1mol NaOH ��Ӧ
D.1 mol ������ Y ������� 5 mol H2 �����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�A��B��C��D��EΪ��������Ԫ���е����ֻ���������ɵĻ������֪A����Է�������Ϊ28��B�����к���18�����ӣ����ֻ�������ת����ϵ��ͼ��ʾ������˵��������ǣ� ��
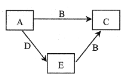
A. X��Y��ɻ�����ķе�һ����X��Z��ɻ�����ķе��
B. Y������������ˮ����Ϊ����
C. Y��Z��ɵķ��ӿ���Ϊ�Ǽ��Է���
D. W������������ԭ�Ӱ뾶��С��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�߷��ӻ����� F �ĺϳ�·�����£�
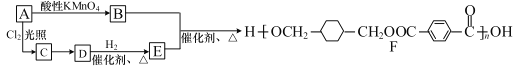
��1��A �ķ���ʽΪ C8H10���� A��E �Ľṹ��ʽ�ֱ���_________��_________��
��2��A��B �ķ�Ӧ������_________��
��3��д�� C��D �ķ�Ӧ����ʽ��_________ ��
��4��H �� E ��һ��ͬ���칹�壬������к��� 3 �ֲ�ͬ��ѧ�������⣬��ʹ��ˮ��ɫ��1mol �÷�������� 2 mol Na ��Ӧ��д������������ H �ṹ��ʽ_________��дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ 8NH3��6NO2 12H2O��7N2 ���ѳ������е� NO2�������йظ÷�Ӧ��˵������ȷ����
12H2O��7N2 ���ѳ������е� NO2�������йظ÷�Ӧ��˵������ȷ����
A.NH3��������
B.NO2����������Ӧ
C.��ԭ�ԣ�NO2��N2
D.ÿ���� 0.7mol N2����Ӧת�� 2.4��6.02��1023 ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������³������ؾ����������ṹ�����������Ļ��ϼ۲���Ϊ0�ۣ�����Ϊ��2�ۣ���ͼ��ʾΪ�������ؾ����һ����������������С���ظ���Ԫ����������˵������ȷ����

A. ������ÿ��K+��Χ��8��O2����ÿ��O2����Χ��8��K+
B. ��������ÿ��K+���������K+��8��
C. �������صĻ�ѧʽΪKO2��ÿ����������4��K+��4��O2��
D. �����У�0�����멁2��������Ŀ��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������ѧ��Ӧʹ��ˮ��ɫ������ʹ����KMnO4��Һ��ɫ����( )
��SO2�� ��CH3CH2CH=CH2�� ��![]() �� ��CH3CH3
�� ��CH3CH3
A. �٢ڢۢ�B. �ڢ�C. �ڢ�D. �٢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com