
【题目】某高分子化合物 F 的合成路线如下:
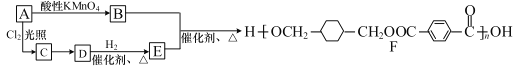
(1)A 的分子式为 C8H10,则 A、E 的结构简式分别是_________、_________。
(2)A→B 的反应类型是_________。
(3)写出 C→D 的反应方程式:_________ 。
(4)H 是 E 的一种同分异构体,其分子中含有 3 种不同化学环境的氢,能使溴水褪色,1mol 该分子最多与 2 mol Na 反应,写出符合条件的 H 结构简式_________任写一种)。
【答案】![]()
![]() 氧化反应
氧化反应 ![]() + 2NaOH
+ 2NaOH![]() + 2NaCl
+ 2NaCl ![]()
【解析】
由合成路线可知,B和E在催化剂加热的条件下发生缩聚反应得到F( ),而A通过酸性高锰酸钾直接得到B,可能是发生的氧化反应,故B为
),而A通过酸性高锰酸钾直接得到B,可能是发生的氧化反应,故B为![]() ,A为
,A为![]() ,A通过在光照条件下与Cl2发生取代反应得到C(
,A通过在光照条件下与Cl2发生取代反应得到C(![]() ),C在NaOH水溶液加热的条件下发生消去反应得到D(
),C在NaOH水溶液加热的条件下发生消去反应得到D(![]() ),D再与H2在催化剂加热条件下发生加成反应得到E(
),D再与H2在催化剂加热条件下发生加成反应得到E(![]() ),满足合成路线,据此可分析解答问题。
),满足合成路线,据此可分析解答问题。
(1)根据上述分析,A的结构简式为![]() ,E的结构简式为
,E的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2) ![]() 与酸性高锰酸钾发生氧化反应得到
与酸性高锰酸钾发生氧化反应得到![]() ,故答案为:氧化反应;
,故答案为:氧化反应;
(3) C在NaOH水溶液加热的条件下发生消去反应得到D,反应方程式为:![]() + 2NaOH
+ 2NaOH![]() + 2NaCl,故答案为:
+ 2NaCl,故答案为:![]() + 2NaOH
+ 2NaOH![]() + 2NaCl;
+ 2NaCl;
(4) H 是 E 的一种同分异构体,能使溴水褪色,分子中含有碳碳双键,又其分子中含有 3 种不同化学环境的氢,且1mol 该分子最多与 2 mol Na 反应,则H的结构简式可能是![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
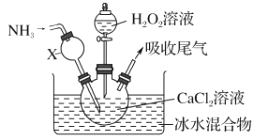
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_______________。
(2)仪器X的主要作用除导气外,还具有的作用是_________。
(3)在冰水浴中进行的原因是______________________。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为__________。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是_______。
a.无水乙醇 b.浓盐酸 c.Na2SO3溶液 d.CaCl2溶液
(6)过氧化钙(与过氧化钠性质相似)可用于长途运输鱼苗,这体现了过氧化钙具有_____的性质。
a.与水缓慢反应供氧 b.能吸收鱼苗呼出的CO2气体 c.能使水体酸性增强
(7)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则所得过氧化钙样品中CaO2的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
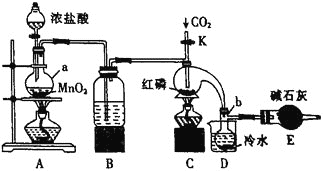
【题目】三氯化磷![]() 是一种重要的有机合成催化剂。实验室常用红磷与干燥的
是一种重要的有机合成催化剂。实验室常用红磷与干燥的![]() 制取
制取![]() ,装置如图所示。
,装置如图所示。
已知:![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,易被氧化,遇水易水解,与
,易被氧化,遇水易水解,与![]() 反应生成
反应生成![]() 。
。
请回答下列问题:
(1)装置A中发生反应的化学方程式为___________。
(2)仪器b的名称是___________,装置B中所装试剂名称是___________,装置E中碱石灰的作用是___________。
(3)实验时,检查装置气密性后,向装置C的曲颈瓶中加入红磷,打开止水夹K通入干燥的![]() ,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥
,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥![]() 的作用是___________。
的作用是___________。![]() 不能用
不能用![]() 代替,理由是___________。
代替,理由是___________。
(4)装置D的作用是___________。
(5)![]() 水解得到亚磷酸
水解得到亚磷酸![]() ,二元弱酸
,二元弱酸![]() ,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
(6)经分析,![]() 产品中含有少量
产品中含有少量![]() ,某同学设计如下实验测定
,某同学设计如下实验测定![]() 的纯度:取
的纯度:取![]() 产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得
产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得![]() 。则该产品中
。则该产品中![]() 的质量分数为___________
的质量分数为___________![]() 保留两位有效数字
保留两位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸苯甲酯(![]() )可以用作香料、食品添加剂及一些香料的溶剂,可通过如下方法合成(部分反应的条件已略去)。
)可以用作香料、食品添加剂及一些香料的溶剂,可通过如下方法合成(部分反应的条件已略去)。
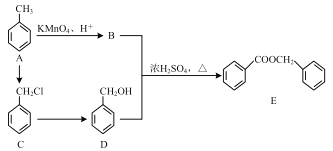
(1)B 的结构简式是 ______ 。
(2)A→C 反应类型是_______。
(3)B、D 中官能团的名称分别是 ____ 、_______。
(4)写出 B+D→E 的反应方程式 _______。
(5)实现由![]() 合成
合成![]() 的流程如下,请你以流程图第一步转化作为示例,将下面流程中所缺部分的反应条件与中间产物补充完整。
的流程如下,请你以流程图第一步转化作为示例,将下面流程中所缺部分的反应条件与中间产物补充完整。
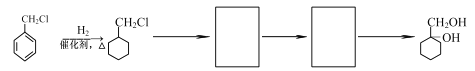 ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
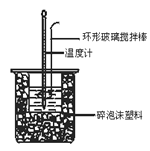
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3与SO2 B. BF3与NH3 C. BeCl2与SCl2 D. H2O与SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
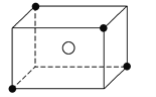
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com