
【题目】利用反应 8NH3+6NO2 12H2O+7N2 可脱除烟气中的 NO2。下列有关该反应的说法中正确的是
12H2O+7N2 可脱除烟气中的 NO2。下列有关该反应的说法中正确的是
A.NH3是氧化剂
B.NO2发生氧化反应
C.还原性:NO2>N2
D.每生成 0.7mol N2,反应转移 2.4×6.02×1023 个电子
科目:高中化学 来源: 题型:
【题目】某同学设计以下实验方案,从海带中提取I2。

(1)操作①的名称是______。
(2)向滤液中加入双氧水的作用是______。
(3)试剂a可以是______(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是________________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 2.9 g 的某有机物完全燃烧,生成 6.6 gCO2 和 2.7 gH2O,下列说法正确的是
A.该有机物只含 C、H 两种元素B.该有机物中可能含有氧元素
C.该有机物的分子式是 C3H6OD.该有机物含有 C、H、O 三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3与SO2 B. BF3与NH3 C. BeCl2与SCl2 D. H2O与SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲制备并探究![]() 的某些性质。
的某些性质。
(1)下列实验方案适用于在实验室制取所需![]() 的是________。
的是________。
A.![]() 溶液与
溶液与![]()
![]() 固体与浓硫酸
固体与浓硫酸
C.固体硫在纯氧中燃烧 ![]() 高温煅烧硫铁矿
高温煅烧硫铁矿
(2)探究二氧化硫的漂白性
甲同学用如图所示装置![]() 气密性良好
气密性良好![]() 进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
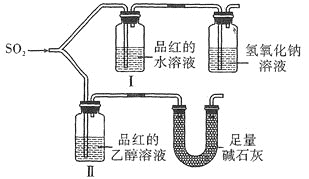
![]() 甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
(3)乙同学设计用如图所示装置验证二氧化硫的化学性质。

![]() 能说明二氧化硫具有氧化性的实验序号为________
能说明二氧化硫具有氧化性的实验序号为________![]() 填字母
填字母![]() 。
。
![]() 为了验证c中
为了验证c中![]() 与
与![]() 发生了氧化还原反应,在上图装置中通入过量的
发生了氧化还原反应,在上图装置中通入过量的![]() 后,取c中的溶液,分成三份,并设计了如下实验:
后,取c中的溶液,分成三份,并设计了如下实验:
方案Ⅰ:往第一份试液中加入酸性![]() 溶液,紫色褪去;
溶液,紫色褪去;
方案Ⅱ:往第二份试液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:往第三份试液中加入用盐酸酸化的![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:______________________________________________。
![]() 试管e中发生反应的离子方程式为______________________________________________。
试管e中发生反应的离子方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同条件对相同体积相同物质的量浓度的 H2O2分解速率的影响,得到如下数据。由此不能得出的结论是:
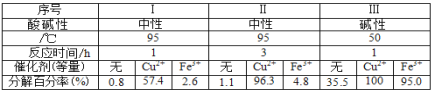
A. Cu2+与 Fe3+对 H2O2 分解都有催化作用,但 Cu2+催化效果更好
B. 由Ⅰ与Ⅱ可知其它条件相同时,时间越长, H2O2 分解越彻底
C. 由Ⅰ与Ⅲ可知其它条件相同时,温度越高, H2O2 分解越快
D. 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强, H2O2 分解越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铜是铜(II)的氯化物,化学式为CuCl2,棕黄色固体,吸收水分后变为蓝绿色的二水合物,实验室用如下装置制备少量无水氯化铜。完成下列填空:
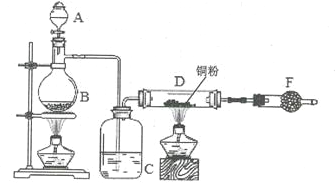
(1)写出烧瓶中(B处)发生反应的化学方程式:____。
(2)c中盛有的试剂为__________,进行实验时应先点燃__(选填“B”或“D”)处酒精灯。
(3)F中盛有碱石灰,其目的是____(选填序号)。
a.吸收HCl b.吸收Cl2c.吸收CO2d.吸收H2SO4
(4)将D中固体改为市售氯化铜(CuCl2.2H2O,Mr=171),也能进行无水氯化铜的制备,此时向D中通入HC1气体,目的是___。若实验条件控制不当,最终得到的物质是碱式氯化铜[化学式为Cu4(OH)nCl(8-n)],且质量是原市售氯化铜的62.7%,则可推算n的值为___(整数值)。
(5)有同学提出将上述装置F(干燥管)改为碱液来处理尾气,请在方框内画出尾气处理装置图__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com