
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
【答案】碱煮水洗 加快反应 热水浴 C 将Fe2+全部氧化为Fe3+;不引入杂质 防止Fe3+水解 加热浓缩、冷却结晶、过滤(洗涤) NH4Fe(SO4)212H2O
【解析】
(1)步骤①的目的是去除废铁屑表面的油污,油污在碱性条件下容易水解,所以工业上常常用热的碳酸钠溶液清洗,即碱煮水洗;
(2)步骤②需要加热的目的是为了加快反应速率;温度保持80~95 ℃,由于保持温度比较恒定且低于水的沸点,故采用的合适加热方式是水浴加热(热水浴);铁屑中含有少量硫化物,硫化物与硫酸反应生成硫化氢气体,可以用氢氧化钠溶液吸收,为了防止倒吸可以加装倒置的漏斗,故选择C装置;
(3)步骤③中选用足量的H2O2,H2O2可以将Fe2+氧化为Fe3+,且H2O2的还原产物为H2O,不会引入新的杂质,故理由是:将Fe2+全部氧化为Fe3+,不引入新的杂质。因为H2O2本身易分解,所以在加入时需分量加入,同时为了防止Fe3+水解,溶液要保持pH小于0.5;
(4)为了除去可溶性的硫酸铵、铁离子等,需要经过的步骤为:加热浓缩、冷却结晶、过滤(洗涤);
(5)设硫酸铁铵的化学式为NH4Fe(SO4)2xH2O,其相对分子质量为266+18x,1.5个水分子的相对分子质量为1.5×18=27,则27/(266+18x)=5.6%,解得x=12,则硫酸铁铵的化学式为NH4Fe(SO4)212H2O。


科目:高中化学 来源: 题型:
【题目】金属及其化合物在人类生活、生产中发挥着重要的作用.
(1)铁是人类应用最广的金属,工业上用铁矿石(主要成分为Fe2O3 )、焦炭、石灰石在高炉中冶炼得到,高炉炼铁的主要化学反应方程式为__________________ ,其中石灰石的作用是____________________ 。
(2)铝是常见的金属,铝制容器既不能存放酸性物质,也不能存放碱性物质,其原因分别用离子方程式表示:_____________、 _____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):

(1)电解质溶液为稀硫酸时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为______________;Al电极上发生的反应为________________________________________________________________________。
(2)电解质溶液为NaOH溶液时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子(分子或离子)均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离子 | 化合物,双核分子 | 单质,双核分子 | 化合物,三核分子 | 化合物,四核分子 | |
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温恒容的密闭容器中充入浓度均为1 mol/L的NH3和HCl,发生NH3(g) + HCl(g)![]() NH4Cl(?) △H = -a kJ/mol,下列说法正确的是
NH4Cl(?) △H = -a kJ/mol,下列说法正确的是
A. 现象为产生白雾
B. 反应物的活化能为a kJ/mol
C. 该条件下,混合气体的平均摩尔质量始终不变
D. 任何温度下,该反应均能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关含碳微粒的说法,按要求填空:
(1)同温度,同浓度的Na2CO3溶液的碱性_________ NaHCO3溶液的碱性(填“大于”、“小于”或“等于”),请设计一个较简便的实验证明___________。
(2)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。
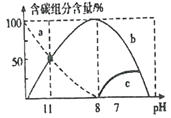
①HC1溶液滴加到一半时,溶液呈___________(填“酸性”、“碱性”或“中性”),理由是____________________(用主要的离子方程式表示)。
②关于图像下列说法正确的是_________________。
A、0.1 mol/L Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)
B、b曲线代表CO32-
C、pH=11时,c(HCO3-) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO32-) + c(OH-)
E、在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
(3)草酸(H2C2O4)溶液具有还原性,将酸性KMnO4溶液滴入草酸溶液中,会产生气泡,且紫红色褪去,写出该反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 molAl3+含有的核外电子数为3NA
B. 1 L 1 mol·L-1醋酸溶液中CH3COO-的数目小于NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24L CCl4中的原子总数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com