
【题目】下列有关含碳微粒的说法,按要求填空:
(1)同温度,同浓度的Na2CO3溶液的碱性_________ NaHCO3溶液的碱性(填“大于”、“小于”或“等于”),请设计一个较简便的实验证明___________。
(2)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。
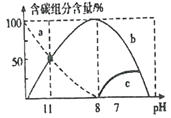
①HC1溶液滴加到一半时,溶液呈___________(填“酸性”、“碱性”或“中性”),理由是____________________(用主要的离子方程式表示)。
②关于图像下列说法正确的是_________________。
A、0.1 mol/L Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)
B、b曲线代表CO32-
C、pH=11时,c(HCO3-) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO32-) + c(OH-)
E、在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
(3)草酸(H2C2O4)溶液具有还原性,将酸性KMnO4溶液滴入草酸溶液中,会产生气泡,且紫红色褪去,写出该反应的离子方程式________________。
【答案】大于 同温、同浓度下测量两者溶液pH值,Na2CO3大 碱性 HCO3-+H2O ![]() H2CO3+OH- ACD 2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
H2CO3+OH- ACD 2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
【解析】
(1)根据碳酸钠和碳酸氢钠的水解程度分析判断两溶液的碱性强弱;根据溶液的酸碱性和pH的关系分析解答;
(2)在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,碳酸钠首先与盐酸反应生成碳酸氢钠和氯化钠,Na2CO3 + HCl = NaHCO3 +NaCl,然后碳酸氢钠继续反应生成二氧化碳和水、氯化钠,NaHCO3 + HCl=NaCl+H2O+CO2↑;根据图像可知,a为CO32-,b为HCO3-,c为CO2,据此分析解答;
(3)草酸(H2C2O4)溶液具有还原性,酸性KMnO4溶液具有强氧化性,根据氧化还原反应方程式的配平原则书写并配平方程式。
(1)碳酸根离子的水解程度大于碳酸氢根离子,同温度,同浓度的Na2CO3溶液的碱性大于NaHCO3溶液的碱性;可以根据等物质的量浓度的Na2CO3溶液和NaHCO3溶液的pH的大小判断溶液的碱性强弱,故答案为:大于;同温、同浓度下测量两者溶液pH值,Na2CO3大于NaHCO3;
(2)在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,碳酸钠首先与盐酸反应生成碳酸氢钠和氯化钠,Na2CO3 + HCl = NaHCO3 +NaCl,然后碳酸氢钠继续反应生成二氧化碳和水、氯化钠,NaHCO3 + HCl=NaCl+H2O+CO2↑;根据图像可知,a为CO32-,b为HCO3-,c为CO2。
①根据上述分析,HC1溶液滴加到一半时,恰好生成碳酸氢钠,碳酸氢钠水解,溶液呈碱性,水解的离子方程式为HCO3-+H2O ![]() H2CO3+OH-,故答案为:碱性;HCO3-+H2O
H2CO3+OH-,故答案为:碱性;HCO3-+H2O ![]() H2CO3+OH-;
H2CO3+OH-;
②A、任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A正确;B、根据上述分析,b曲线代表HCO3-,故B错误;C、根据图像,pH=11时,溶液中含有等物质的量浓度的Na2CO3和NaHCO3,此时溶液显碱性,以碳酸钠的水解为主,根据方程式生成的氯化钠少于溶液中的碳酸氢钠,因此c(HCO3-) > c(Cl-),故C正确;D、根据图像,pH=11时,溶液中含有等物质的量浓度的Na2CO3和NaHCO3,溶液中c(HCO3-) = c(CO32-),结合电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),则c(Na+) + c(H+) = 3c(CO32-) + c(OH-),故D正确;E、根据图像,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,如pH=7时,几乎没有CO32-,故E错误;正确的有ACD,故答案为:ACD;
(3)草酸(H2C2O4)溶液具有还原性,酸性KMnO4溶液具有强氧化性,向盛有草酸饱和溶液的试管中滴入几滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,说明草酸被酸性高锰酸钾氧化,根据氧化还原反应方程式的配平原则:得失电子守恒、质量守恒和电荷守恒配平该反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。


科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制0.500 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、__________、_______.
(2)本实验须称量碳酸钠晶体(Na2CO310H2O)________g。
(3)①如果定容时仰视会导致溶液浓度__________(填“偏高”、“偏低”或“无影响” 下同);
②容量瓶未经干燥就用来配制该溶液,会导致溶液浓度_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,pH=4的CH3COOH溶液中,由水电离的c(H+) = 10-10 mol/L
B. 将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C. 0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D. 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g)发生反应H2(g) + CO2(g) ![]() H2O(g) + CO(g),其起始浓度如表所示,已知平衡时甲中H2的转化率为60%。下列判断正确的是
H2O(g) + CO(g),其起始浓度如表所示,已知平衡时甲中H2的转化率为60%。下列判断正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)[mol/L] | 0.010 | 0.020 | 0.020 |
c(CO2)[mol/L] | 0.010 | 0.010 | 0.020 |
A. 刚开始反应时,乙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,乙中H2的转化率大于60%
C. 平衡时,丙中c(CO) = 0.008 mol/L
D. 该温度下,平衡常数K=9/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中,能大量共存的是( )
A.使pH试纸显蓝色的溶液:Cu2+、NO![]() 、Fe3+、SO
、Fe3+、SO![]()
B.与铁粉反应放出H2的无色溶液:NO![]() 、Fe2+、Na+、SO
、Fe2+、Na+、SO![]()
C.使红色石蕊试纸变蓝的溶液:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
D.Na2CO3溶液:Al3+、SO![]() 、Cl-、K+
、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com