
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):

(1)电解质溶液为稀硫酸时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为______________;Al电极上发生的反应为________________________________________________________________________。
(2)电解质溶液为NaOH溶液时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为________________________。
【答案】 亮 Mg-2e-===Mg2+ 2H++2e-===H2↑ 亮 Al+4OH--3e-===AlO![]() +2H2O
+2H2O
【解析】试题分析:(1)镁、铝、稀硫酸能构成原电池;镁活泼性大于铝,镁是负极;(2) 镁、铝、氢氧化钠能构成原电池;镁与氢氧化钠不反应、铝与氢氧化钠反应生成偏铝酸钠;
解析:(1) 镁、铝、稀硫酸能构成原电池,所以灯泡亮;镁活泼性大于铝,镁是负极,电池总反应为![]() ,Mg电极上发生的反应为Mg-2e-===Mg2+;Al是正极,电极上发生的反应为2H++2e-===H2↑。
,Mg电极上发生的反应为Mg-2e-===Mg2+;Al是正极,电极上发生的反应为2H++2e-===H2↑。
(2)电解质溶液为NaOH溶液时,镁、铝、氢氧化钠能构成原电池,灯泡亮,镁与氢氧化钠不反应、铝与氢氧化钠反应生成偏铝酸钠,电池总反应为![]() ;
;
Al是负极,电极上发生的反应为Al+4OH--3e-===AlO![]() +2H2O。
+2H2O。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,全部属于纯净物的是( )
A. 福尔马林、白酒、醋 B. 丙三醇、氯仿、乙醇钠
C. 苯、汽油、无水酒精 D. 甘油、冰醋酸、煤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=260kJmol﹣1
2CO(g)+2H2(g) △H=260kJmol﹣1
已知:2CO(g)+O2(g)![]() 2CO2(g) △H=﹣566kJmol﹣1
2CO2(g) △H=﹣566kJmol﹣1
则CH4与O2反应生成CO和H2的热化学方程式为 。
(2)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处电极上发生的电极反应式: ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度 (填写“变大”、“变小”或“不变”),装置Ⅱ中Cu电极上发生的电极反应式: 。
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。

答
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为 (填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)= molL-1。
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NaHCO3 受热分解的过程中,只有离子键被破坏
B. Ba(OH)2 中既存在共价键又存在离子键
C. 液态水汽化时,共价键断开,氢键无变化
D. 干冰熔化时破坏共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)为一元酸,具有较强的还原性。可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴膜),下列说法描述错误的是

A. 阳极室反应为:2H2O-4e-=O2↑+4H+
B. ab,ef均为阳膜,cd为阴膜
C. 若将稀H2SO4改为H3PO2,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4
D. 通电后产品室中的H+离子向原料室迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为CrO42﹣![]() Cr2O72﹣
Cr2O72﹣![]() Cr3+
Cr3+![]() Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+
Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+![]() Cr2O72﹣(橙色)+H2O
Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
a.Cr2O72﹣和CrO42﹣的浓度相同 b.v正(Cr2O72﹣)=2v逆(CrO42﹣)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中Cr2O72﹣转变为Cr3+的离子方程式: .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)![]() Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O ![]() Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是
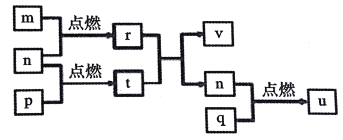
A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧C(s)+O2(g)═CO2(g)(放热Q1kJ)
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2kJ)
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)
2H2(g)+O2(g)═2H2O(g)(共放热Q3kJ)
试回答下列问题:
①判断两种途径放出热量大小:途径I ______(填“大于”、“等于”或“小于”)途径II
②Q 1、Q 2 、Q 3 的数学关系式是________________________。
③已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。
其他相关数据如下表:则表中x的值为_____________。
O===O | H—H | H—O(g) | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
④简述煤通过途径Ⅱ作为燃料的意义:______________________________

(2)化学反应可视为旧键断裂和新键形成的过程。如图为白磷(P4)和P4O6分子的分子结构示意图,其他相关数据如下表所示。则反应P4 +3O2 = P4O6的热量变化为:__________________。
O===O | P—P | P—O | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 198 | 360 |
(3)下列变化中属于放热反应的是______
A.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温锻烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com