
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为CrO42﹣![]() Cr2O72﹣
Cr2O72﹣![]() Cr3+
Cr3+![]() Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+
Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+![]() Cr2O72﹣(橙色)+H2O
Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
a.Cr2O72﹣和CrO42﹣的浓度相同 b.v正(Cr2O72﹣)=2v逆(CrO42﹣)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中Cr2O72﹣转变为Cr3+的离子方程式: .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)![]() Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O ![]() Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
【答案】(10分)
(1)橙;
(2)cd;
(3)Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O;
(4)溶液由紫色变为亮绿色;
(5)Cr3+、Cr2O72﹣(各2分)
【解析】
试题分析:
(1)第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
(2)当反应达到平衡状态时,任何微粒的浓度都保持不变。对每种微粒来说消耗的浓度与产生的浓度相等,即V(正)=V(逆)。溶液的颜色不变,溶液的pH不变,v正 (Cr2O72—) =1/2v 逆(CrO42—).但不同的微粒的浓度可能相等,也可能不等。因此能说明第①步反应达平衡状态的是cd。
(3)根据电荷守恒、原子守恒及电子守恒定律可知:第②步中Cr2O72-转变为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
(4)现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液时,c(Cr3+)=0. 1mol/L,n(Cr3+)=0.005mol ,c(OH-)=0.3mol/L,溶液的pH>4.6所以会发生反应Cr3++3OH-=Cr(OH)3↓, 反应消耗OH-的物质的量为0.015mol,剩余OH-的物质的量为0.3mol/L×0.1L- 0.015mol=0.015mol,c(OH-)=0.015mol ÷0.1L=0.15mol/L.大于pH=13时的c(OH-)。所以会再发生 Cr(OH)3+ H2O=H++ [Cr(OH)4]2-。因此溶液呈亮绿色。即溶液的颜色由紫色变为亮绿色。
(5)在Na[Cr(OH)4] 溶液中加入H2SO4酸化由关系式![]()
![]() 可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+
可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。


科目:高中化学 来源: 题型:
【题目】下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ
B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
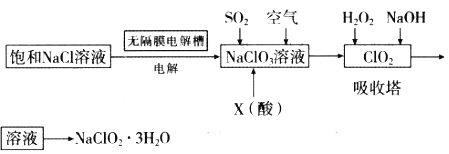
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体在中性和碱性溶液中不能稳定存在。
回答下列问题:
(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的_________(填化学式),至沉淀不再产生后。再加入过里的Na2CO3和NaOH,充分反应后将沉淀一并滤去。在无隔膜电解槽中用惰性电极电解一段时间生成NaClO3,阳极反应式为_______
(2)X酸是_________。写出二氧化氯发生器中生成ClO2的化学方程式_______,吸收塔内的温度不宜过高的原因为________
(3)亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2有毒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析正确的是(_____)
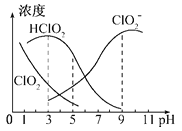
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的浓度随PH增大而增大
C.PH=6时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 25℃时,该溶液在pH=4时比pH=2时更适合漂白
(4)aKg 30%的双氧水理论上可最多制得___Kg NaClO2·3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):

(1)电解质溶液为稀硫酸时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为______________;Al电极上发生的反应为________________________________________________________________________。
(2)电解质溶液为NaOH溶液时,灯泡________ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是 。
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)请计算待测烧碱溶液的浓度 mol/L。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①2Fe(s)+O2(g)=2 FeO(s)△H1=﹣544.0kJmol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s)△H2=﹣3351.4kJmol﹣1。
Al和FeO发生铝热反应的热化学方程式是
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
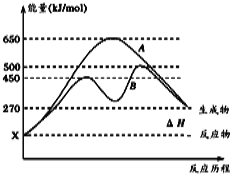
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为 (填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJmol﹣1,该反应的活化能为334.4kJmol﹣1,则其逆反应的活化能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 L 0.1 mol·L-1的CuCl2溶液中含Cu2+为0.1NA
B.标准状况下,22.4 L CCl4含CCl4分子为NA
C.1mol H3O+含质子数为10 NA
D.1molNa2O和Na2O2混合物中含阴离子的总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
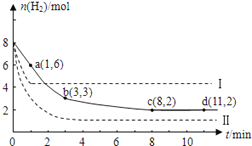
(1)第一分钟内H2的平均反应速率是________列式并计算该温度下的化学平衡常数K=______
(2)下列时间段平均反应速率最大的是_______
A.0-1min B.1-3min C.3-8min D.8-11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是__________,曲线Ⅱ对应的实验条件改变的是_____________。
(4)若在d点时向体系内充入2molCO2和2molH2O,此时V正_____V逆(大于,小于,等于)
(5)已知:
①CO(g)+1/2O2(g)=CO2(g); ΔH1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g); ΔH2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ΔH3=-192.2kJ/mol
在工业上常用CO和H2合成甲醇,该反应的热方程式为_____________
(6)如图是甲醇燃料电池原理示意图,回答下列问题:电池负极的电极反应是:__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中常设计化学知识,下列说法正确的是
A. “海市蜃楼”现象是胶体的丁达尔效应造成的
B. 明矾可用于再来水的净化和消毒
C. 在香蕉箱中放入浸有KMnO4溶液的硅藻土可延长保鲜期
D. 由于碘单质受热易升华,所以炒菜时加碘盐最后放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com