
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是 。
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)请计算待测烧碱溶液的浓度 mol/L。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
【答案】(12分)
(1)红;无;
(2)B
(3)待测溶液润洗锥形瓶;偏高;(各2分)
(4)据酸式滴定管用蒸馏水洗净后,应用标准液润洗;(2分)
(5)22.60;
(6)0.0800(2分)
【解析】
试题分析:
(1)锥形瓶放入的NaOH溶液,酚酞作指示剂,溶液显红色,当滴加到终点时,溶液的颜色由红色变为无色,且半分钟内不恢复颜色;
(2)滴定过程中,眼睛注视锥形瓶内溶液颜色的变化,判断是否滴定到终点;故答案为B。
(3)锥形瓶不能待测液润洗,否则造成锥形瓶中待测液的物质的量增多,消耗的标准液的体积增大,根据c(NaOH)=c标×V标/V(NaOH),待测液的浓度偏高;
(4)滴定管要用待盛液润洗,否则进行稀释,浓度变小;故答案为:据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)滴定管的读数到0.01mL,因此数值为22.60mL;
(6)两次分别消耗的盐酸的体积为19.9、20.1,平均消耗盐酸的体积为:20mL,c(NaOH)=20×0.1/25mol·L-1=0.08mol·L-1。


科目:高中化学 来源: 题型:
【题目】图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 ( )
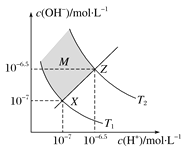
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性的无色透明溶液中能够大量共存的是
A.NH4+ 、Fe3+、SO42-、Cl- B.Mg2+、Ag+、CO32-、Cl-
C.K+、NH4+、SO42-、Cl- D.K+、Na+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NaHCO3 受热分解的过程中,只有离子键被破坏
B. Ba(OH)2 中既存在共价键又存在离子键
C. 液态水汽化时,共价键断开,氢键无变化
D. 干冰熔化时破坏共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液③ 氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是:
A.分液、蒸馏、萃取 B.萃取、蒸馏、分液
C.分液、萃取、蒸馏 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为CrO42﹣![]() Cr2O72﹣
Cr2O72﹣![]() Cr3+
Cr3+![]() Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+
Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+![]() Cr2O72﹣(橙色)+H2O
Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
a.Cr2O72﹣和CrO42﹣的浓度相同 b.v正(Cr2O72﹣)=2v逆(CrO42﹣)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中Cr2O72﹣转变为Cr3+的离子方程式: .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)![]() Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O ![]() Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.1mol·L﹣1 NaOH溶液中逐滴加入0.1mol·L﹣1的CH3COOH溶液,其pH逐渐减小,图中a、b、c三点的pH为实验中所测得。下列有关说法中一定正确的是
![]()
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO﹣)>c(Na+)
D.继续滴加0.1 mol·L﹣1的CH3COOH溶液,溶液的pH最终可以变化至1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
A.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×10-4
Fe3++3H2O的平衡常数K=4.0×10-4
D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com