
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
A.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×10-4
Fe3++3H2O的平衡常数K=4.0×10-4
D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-5molL-1
【答案】A
【解析】
试题分析:A、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明硫酸钙的溶解度小,但二者阴阳离子个数比不同,不能说明Ksp大小,错误;B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关,正确;C、Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+),反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=c(Fe3+)/c3(H+)=[c3(OH-)·c(Fe3+)]/K3w=4.0×104,正确;D、混合液的pH=11,Ksp[Mg(OH)2]=c2(OH-)·c(Mg2+),c(OH-)=10-3,带入求得c(Mg2+)=1.8×10-5 mol·L—1,正确;故答案选A。
Fe3++3H2O的平衡常数K=c(Fe3+)/c3(H+)=[c3(OH-)·c(Fe3+)]/K3w=4.0×104,正确;D、混合液的pH=11,Ksp[Mg(OH)2]=c2(OH-)·c(Mg2+),c(OH-)=10-3,带入求得c(Mg2+)=1.8×10-5 mol·L—1,正确;故答案选A。


科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,制备氯化亚铜的生产工艺如下:
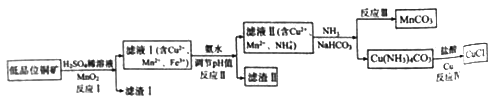
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是 。
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)请计算待测烧碱溶液的浓度 mol/L。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 L 0.1 mol·L-1的CuCl2溶液中含Cu2+为0.1NA
B.标准状况下,22.4 L CCl4含CCl4分子为NA
C.1mol H3O+含质子数为10 NA
D.1molNa2O和Na2O2混合物中含阴离子的总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经 X 射线研究证明:PCl5 在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,下列关于 PCl5 的推断正确的是( )
A. PCl5 晶体中不存在离子键
B. PCl5 晶体具有良好的导电性
C. PCl5 晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为 1:1
D. PCl5 晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
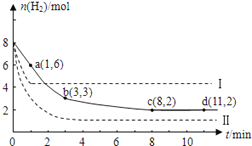
(1)第一分钟内H2的平均反应速率是________列式并计算该温度下的化学平衡常数K=______
(2)下列时间段平均反应速率最大的是_______
A.0-1min B.1-3min C.3-8min D.8-11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是__________,曲线Ⅱ对应的实验条件改变的是_____________。
(4)若在d点时向体系内充入2molCO2和2molH2O,此时V正_____V逆(大于,小于,等于)
(5)已知:
①CO(g)+1/2O2(g)=CO2(g); ΔH1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g); ΔH2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ΔH3=-192.2kJ/mol
在工业上常用CO和H2合成甲醇,该反应的热方程式为_____________
(6)如图是甲醇燃料电池原理示意图,回答下列问题:电池负极的电极反应是:__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。

①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g)![]() N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中,![]() (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。

(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________。电池工作一点时间后,电解质溶液的pH将_______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )

A.M的相对分子质量是180
B.1 mol M最多能与2 mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1 mol M与足量H2反应,最多消耗5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的生产、生活息息相关。下列有关说法正确的是:
A.煤的干馏和石油的分馏都属于化学变化
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
D.铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com