
����Ŀ����ͼ��ʾ��ѧ��Ӧ�����е������仯����ͼ�ж�����˵���к��������� ��

A��500mL 2.0mol��L��1 HCl��500mL 2.0mol��L��1 NaOH�ķ�Ӧ����ͼ1���Ҧ�E��57.3kJ
B��500mL 2.0mol��L��1 H2SO4��500mL 2.0mol��L��1 Ba��OH��2�ķ�Ӧ����ͼ2���Ҧ�E��114.6kJ
C������ͼ1�����仯���κη�Ӧ��һ��������ȼ��ɷ���
D��CaO��Ũ��������ˮʱ�������仯����ͼ1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ᡢ�������������Һ�д�������ƽ�⼰���Ӧ��ƽ�ⳣ��
CH3COOH![]() CH3COO����H�� ��H1��0 (K1��1.75��10��5)
CH3COO����H�� ��H1��0 (K1��1.75��10��5)
CH3COO����H2O![]() CH3COOH��OH�� ��H2��0 ( K2��5.71��10��10 )
CH3COOH��OH�� ��H2��0 ( K2��5.71��10��10 )
�����£���������������ʵ���Ũ�ȵĴ���ʹ�������Һ��ϣ�����������ȷ����( )
A�������ҺpH��7
B���Ի����Һ�����ȣ�K1����K2��С
C�����ڻ����Һ��pH�����ԣ����ʱ��Һ��c(Na��)��c(CH3COO��)
D���¶Ȳ��䣬���ڻ����Һ�м�������NaOH���壬c(CH3COO��)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ�������������ʵ���Ũ�ȵ���Һ�Ķ������������ϱ��У����¶ȡ���Ũ�ȡ�����������ѹǿ�����̶����������еģ� ��
A. �ڢ� B. �ۢ� C. �٢ڢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ȫ�����ڴ��������( )
A. �������֡��ơ��� B. ���������ȷ¡��Ҵ���
C. �������͡���ˮ�ƾ� D. ���͡������ᡢú
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ʾˮ��c(H��)��c(OH��)�Ĺ�ϵ�������жϴ������ ( )
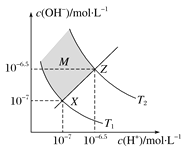
A������������������c(H��)��c(OH��)��Kw
B��M��������������c(H��)��c(OH��)
C��ͼ��T1��T2
D��XZ������������pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������ȥ��Ӧ����
A. �Ҵ���Ũ���Ṳ�ȵ�140�� B. �Ҵ��������ᣨHBr����Ӧ
C. �Ҵ���������Ӧ������ȩ D. �Ҵ���Ũ���Ṳ����170��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǵ���Ҫ�ɷ֣��������ᴩ��������������ʷ�������������ص������ʷ����Ҳ����ǧ�����ϡ�
��1��д��������ˮ��Һ�еĵ��뷽��ʽ_____________
��2��25���£�CH3COOH��ˮ�е���Ħ�HΪ+8.8kJ/mol�����볣��KaΪ2��10-5����֪HCl(aq)��NaOH(aq)��Ӧ�Ħ�HΪ-57.3kJ/mol����CH3COONaˮ��ʱ�Ħ�HΪ_____��ˮ��ƽ�ⳣ��ΪKhΪ_______��
���������о����������Ὺ�����¹��պϳ�����������ʹ��Ʒ�ɱ����Խ��ͣ�����Ҫ��ӦΪ��
CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l)
CH3COOC2H5(l)
��3���÷�Ӧ�����л���Ӧ�����е�_____________��
��4������������˵����ϩ������ϳ����������ķ�Ӧ�Ѵﻯѧƽ�����____________��
A.��ϩ�����ᡢ����������Ũ����ͬ
B.�����ϳɷ�Ӧ�����������ֽⷴӦ���������
C.��ϩ�Ͽ�1mol̼̼˫����ͬʱ����ǡ������1mol
D.��ϵ����ϩ�İٷֺ���һ��
��ͼΪn(��ϩ)��n(����)���ϱ�Ϊ1ʱ���ڲ�ͬѹǿ�½���������ͬʱ������������IJ������¶ȵı仯�IJⶨʵ�飬ʵ������ͼ��ʾ���ش���������:
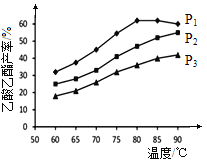
��5���¶���60~80�淶Χ�ڣ���ϩ�����������ϳɷ�Ӧ�����ɴ�С��˳����________[��![]() (P1)��
(P1)��![]() (P2)��
(P2)��![]() (P3)�ֱ��ʾ��ͬѹǿ�µķ�Ӧ����]��������ԭ��Ϊ____________��
(P3)�ֱ��ʾ��ͬѹǿ�µķ�Ӧ����]��������ԭ��Ϊ____________��
��6��ѹǿΪP1MPa���¶�60��ʱ�������������IJ���Ϊ30�G�����ʱ��ϩ��ת����Ϊ_______��
��7��ѹǿΪP1MPa���¶ȳ���80��ʱ���������������½���ԭ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊһ������Դ�ڻ�ѧ����Ӧ�ù㷺����ش��������⣺
(1)��¯ұ�������У������ڴ���Ӧ���в���ˮú��(CO��H2)��ԭ���������йط�ӦΪ��
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H=260kJmol��1
2CO(g)+2H2(g) ��H=260kJmol��1
��֪��2CO(g)+O2(g)![]() 2CO2(g) ��H=��566kJmol��1
2CO2(g) ��H=��566kJmol��1
��CH4��O2��Ӧ����CO��H2���Ȼ�ѧ����ʽΪ ��
(2)��ͼ��ʾ��װ����Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ����ʵ�������϶�ͭ��
��b���缫�Ϸ����ĵ缫��Ӧʽ�� ��
����ƽ�����װ������KOH��Һ��Ũ�� (��д���������С�����䡱)��װ������Cu�缫�Ϸ����ĵ缫��Ӧʽ�� ��
���ڴ˹���������ȫ��Ӧ��װ���������������仯12.8g����װ���������������ļ��� L(��״����)��

��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72����CrO42�������ǻ�����༰��̬ϵͳ�����ܴ���˺���������д������÷��Ĺ�������ΪCrO42��![]() Cr2O72��
Cr2O72��![]() Cr3+
Cr3+![]() Cr(OH)3�� ���е���������ƽ�⣺2CrO42������ɫ��+2H+
Cr(OH)3�� ���е���������ƽ�⣺2CrO42������ɫ��+2H+![]() Cr2O72������ɫ��+H2O
Cr2O72������ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ�� ɫ��
��2����˵����������Ӧ��ƽ��״̬���� ����ѡ���ţ�
a��Cr2O72����CrO42����Ũ����ͬ b��v��(Cr2O72��)=2v��(CrO42��)
c����Һ����ɫ���� d����Һ��pHֵ����
��3��д����������Cr2O72��ת��ΪCr3+�����ӷ���ʽ�� ��
��4����Cr2(SO4)3��Һ�У��μ�NaOH����pH=4.6ʱ����ʼ����Cr(OH)3����������pH�����ߣ��������࣬����pH��13ʱ��������ʧ����������ɫ��[Cr��OH��4]�����ӣ���ƽ���ϵ���£�H++[Cr(OH)4]��������ɫ��![]() Cr��OH��3��s������ɫ��+H2O
Cr��OH��3��s������ɫ��+H2O ![]() Cr3+����ɫ��+H2O +3OH��������0.05mol��L��1��Cr2(SO4)3��Һ50mL�У���������0.6mol��L��1��NaOH��Һ����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ ��
Cr3+����ɫ��+H2O +3OH��������0.05mol��L��1��Cr2(SO4)3��Һ50mL�У���������0.6mol��L��1��NaOH��Һ����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ ��
��5����Na[Cr��OH��4]��Na2Cr2O7��Ϻ����Һ�м���H2SO4�ữ����Ԫ���� ��ʽ���ڣ���д���ӷ��ţ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com