
【题目】下列叙述正确的是( )
A.制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸
B.SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同
C.可用CuSO4溶液除去制乙炔时混有的杂质H2S
D.在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI)
科目:高中化学 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
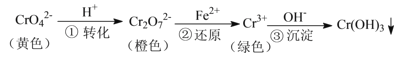
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
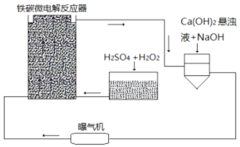
【题目】铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示。
请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为______,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为:______。
(2)其治理污水原理主要有以下几个方面:
①一些不活泼的重金属离子被Fe置换出来。写出从![]() 中置换金的离子方程式______。
中置换金的离子方程式______。
②在处理过程中,有些胶体会发生电泳,向某极富集,从而聚沉除去。![]() 胶体电泳时,会向______极移动。
胶体电泳时,会向______极移动。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
A.都有还原性![]() 表面积都很大
表面积都很大![]() 都含金属元素
都含金属元素![]() 都是胶体
都是胶体
④过程中产生的![]() 能沉淀或结合一些无机阴离子
能沉淀或结合一些无机阴离子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制备
。由FeS制备![]() 气体可选用______。
气体可选用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀盐酸
稀盐酸![]() 浓硫酸
浓硫酸
(3)溶液中的Fe元素最终均转化为![]() 沉淀除去。为更好除去
沉淀除去。为更好除去![]() 和
和![]() ,请参考装置图,从试剂用量角度提出可以采取哪些措施
,请参考装置图,从试剂用量角度提出可以采取哪些措施![]() 回答一条即可
回答一条即可![]() ______。
______。
(4)已知常温下,![]() ;
;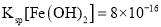 。
。
①计算![]() 的水解常数为______。
的水解常数为______。
②向饱和![]() 、
、![]() 混合溶液中,逐渐加入少量固体
混合溶液中,逐渐加入少量固体![]() 忽略体积和温度变化
忽略体积和温度变化![]() ,
,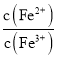 会______,
会______,![]() 选填“逐渐增大”、“逐渐减小”、“不变”
选填“逐渐增大”、“逐渐减小”、“不变”![]() 。结合相关数据推理说明原因______。
。结合相关数据推理说明原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是
A. 1×(10-14+10-10) mol·L-1 B. ![]()
![]() mol·L-1
mol·L-1
C. 2×10-10 mol·L-1 D. 2×10-14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O。下列说法正确的是
2K2FeO4+3KNO2+2H2O。下列说法正确的是
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子为4 mol
D.K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B. 常温常压下,14g由乙烯与丙烯组成的混合气体含有的原子数目为3NA
C. 1mol·L-1醋酸溶液中所含CH3COOH分子总数一定小于NA
D. 标准状况下,11.2L己烯中含有的碳原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com