
【题目】25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是
A. 1×(10-14+10-10) mol·L-1 B. ![]()
![]() mol·L-1
mol·L-1
C. 2×10-10 mol·L-1 D. 2×10-14 mol·L-1
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )

A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置有洗气、储气等用途。在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水。对该装置的说法正确的是
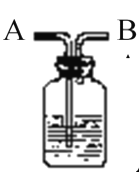
A.导管B连接供给氧气的钢瓶
B.导管B连接病人吸氧气的塑胶管
C.可用来观察输出氧气的速度
D.可用来调节输出氧气的速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-)
B.![]() =10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4)+c(NH3·H2O)+c(Na+)=2c(Cl-)
D.0.1mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸
B.SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同
C.可用CuSO4溶液除去制乙炔时混有的杂质H2S
D.在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前有效控制及高效利用CO、![]() 的研究正引起全球广泛关注,根据
的研究正引起全球广泛关注,根据![]() 中国化工报
中国化工报![]() 报道,美国科学家发现了几种新的可将CO、
报道,美国科学家发现了几种新的可将CO、![]() 转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
已知工业上可以利用![]() 制备
制备![]() 涉及反应如下:
涉及反应如下:
反应I:![]()
反应II:![]()
(1)写出工业上CO和![]() 制取甲醇的热化学方程式 ______ 。
制取甲醇的热化学方程式 ______ 。
(2)反应I能自发进行的条件是 ______。
(3)一定温度下,![]() 、CO在体积固定的密闭容器中发生如下反应:
、CO在体积固定的密闭容器中发生如下反应:![]() ,下列选项能判断该反应达到平衡状态的依据有 ______ 。
,下列选项能判断该反应达到平衡状态的依据有 ______ 。
A.该反应的平衡常数不变
![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率
的生成速率
C.容器内的压强保持不变
![]() 混合气体的密度保持不变
混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)500K,![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 的
的 ![]() 和
和![]() 仅发生反应I,该反应10min时生成
仅发生反应I,该反应10min时生成 ![]() ,此时达到平衡:
,此时达到平衡:
①用氢气表示该反应的速率为 ______ 。
②该温度下,反应I的平衡常数为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com