
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )

A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
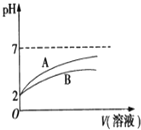
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
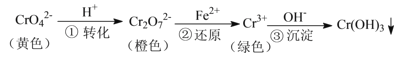
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
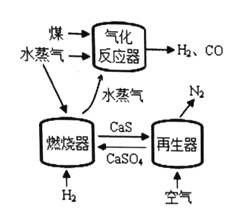
燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:
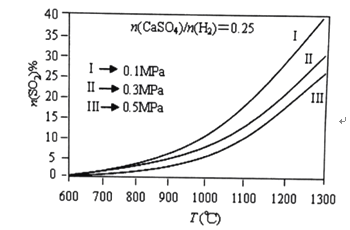
①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
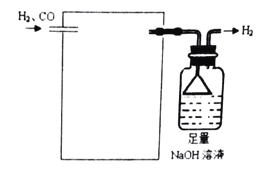
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。
(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大
B.0.1 mol·L-1的醋酸溶液,由水电离出来的c(H+)=1.0×10-13 mol·L-1
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
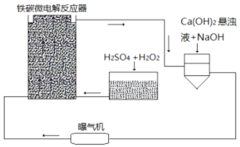
【题目】铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示。
请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为______,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为:______。
(2)其治理污水原理主要有以下几个方面:
①一些不活泼的重金属离子被Fe置换出来。写出从![]() 中置换金的离子方程式______。
中置换金的离子方程式______。
②在处理过程中,有些胶体会发生电泳,向某极富集,从而聚沉除去。![]() 胶体电泳时,会向______极移动。
胶体电泳时,会向______极移动。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
A.都有还原性![]() 表面积都很大
表面积都很大![]() 都含金属元素
都含金属元素![]() 都是胶体
都是胶体
④过程中产生的![]() 能沉淀或结合一些无机阴离子
能沉淀或结合一些无机阴离子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制备
。由FeS制备![]() 气体可选用______。
气体可选用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀盐酸
稀盐酸![]() 浓硫酸
浓硫酸
(3)溶液中的Fe元素最终均转化为![]() 沉淀除去。为更好除去
沉淀除去。为更好除去![]() 和
和![]() ,请参考装置图,从试剂用量角度提出可以采取哪些措施
,请参考装置图,从试剂用量角度提出可以采取哪些措施![]() 回答一条即可
回答一条即可![]() ______。
______。
(4)已知常温下,![]() ;
;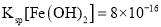 。
。
①计算![]() 的水解常数为______。
的水解常数为______。
②向饱和![]() 、
、![]() 混合溶液中,逐渐加入少量固体
混合溶液中,逐渐加入少量固体![]() 忽略体积和温度变化
忽略体积和温度变化![]() ,
,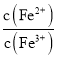 会______,
会______,![]() 选填“逐渐增大”、“逐渐减小”、“不变”
选填“逐渐增大”、“逐渐减小”、“不变”![]() 。结合相关数据推理说明原因______。
。结合相关数据推理说明原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是
A. 1×(10-14+10-10) mol·L-1 B. ![]()
![]() mol·L-1
mol·L-1
C. 2×10-10 mol·L-1 D. 2×10-14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O。下列说法正确的是
2K2FeO4+3KNO2+2H2O。下列说法正确的是
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子为4 mol
D.K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com