
【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
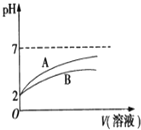
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度
【答案】![]() A
A ![]()
![]() 正
正 ![]() d
d
【解析】
(1)NaCN溶液中CN-离子水解,溶液显碱性,溶液中离子浓度大小为:![]() ;
;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() ,这说明醋酸酸性大于氰酸,稀释相同倍数,酸性弱的溶液pH变化小,则HCN溶液pH变化小,A为醋酸变化曲线,酸越弱对应盐水解程度越大,相同条件下同浓度的NaCN溶液的pH大于
,这说明醋酸酸性大于氰酸,稀释相同倍数,酸性弱的溶液pH变化小,则HCN溶液pH变化小,A为醋酸变化曲线,酸越弱对应盐水解程度越大,相同条件下同浓度的NaCN溶液的pH大于![]() 溶液的pH,
溶液的pH,
故答案为:![]() ;A;
;A;![]() ;
;
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,化学方程式为
,化学方程式为![]() ,反应中氮元素化合价
,反应中氮元素化合价![]() 价和
价和![]() 价变化为
价变化为![]() 价,电子转移总数为
价,电子转移总数为![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,则转移4mol电子放出热量42.4kJ,标注物质聚集状态和对应反应焓变得到热化学方程式为:
,则转移4mol电子放出热量42.4kJ,标注物质聚集状态和对应反应焓变得到热化学方程式为:![]() ,故答案为:
,故答案为:![]()
![]() ;
;
(3)①![]() ;
;![]() ,此温度下,该反应的平衡常数为400,反应到t时刻测得各组分的浓度计算浓度商
,此温度下,该反应的平衡常数为400,反应到t时刻测得各组分的浓度计算浓度商![]() ,则反应正向进行,故答案为:正;
,则反应正向进行,故答案为:正;
![]() 若经10min反应达到平衡,设平衡消耗氯气浓度x mol/L,则
若经10min反应达到平衡,设平衡消耗氯气浓度x mol/L,则
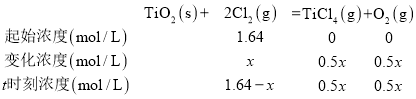
![]() ,
,![]() ,该时间内反应速率
,该时间内反应速率![]() 。
。
a.使用催化剂改变化学反应速率不改变化学平衡,故a错误;
b.反应前后气体不变,增大压强平衡不变,故b错误;
c.反应前后气体不变,减小压强平衡不变,故c错误;
d.反应是吸热反应,升高温度,平衡正向进行,故d正确;
故答案为:![]() ;d。
;d。


科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂采用稀NaOH溶液脱除![]() 。若碱洗脱除后所得废液的pH约为
。若碱洗脱除后所得废液的pH约为![]() 已知:相同温度下饱和
已知:相同温度下饱和![]() 溶液的pH约为
溶液的pH约为![]() ,则下列说法正确的是
,则下列说法正确的是
A.该溶液中:![]()
B.该溶液中:![]()
C.加水稀释该溶液,恢复至原温度,pH增大,![]() 不变
不变
D.该溶液pH约为13的原因:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )

A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+ 2KNO3+ 3C![]() 3CO2↑+ A + N2↑(已配平)
3CO2↑+ A + N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为__________。
②生成物A的晶体类型为__________,含极性共价键的分子的中心原子轨道杂化类型为_______。
③已知CN-与N2结构相似,推算HCN分子中![]() 键与
键与![]() 键数目之比为____________。
键数目之比为____________。
(2)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(3)下列有关说法正确的是______________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图

D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,试写出反应的离子方程式:_______。
(5)氮化硼形成立方晶体,晶体结构类似金刚石,如图所示。
已知:该晶体密度为ρg·㎝-3,NA代表阿伏加德罗常数的值。
①该晶体的化学式为______________。
②在该晶体中,B与N形成共价键的键长(d)为________________________pm(列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
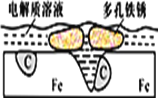
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )

A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com