
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
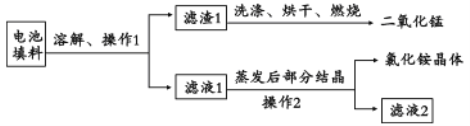
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:

用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增小
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的105倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的![]() 、
、![]() 等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)![]() 和
和![]() 在空气中存在下列平衡:
在空气中存在下列平衡:
![]() ;
;
![]()
![]()

![]() 通常在
通常在![]() 的存在下,进一步被氧化,生成
的存在下,进一步被氧化,生成![]() 。写出
。写出![]() 和
和![]() 反应的热化学方程式为______。
反应的热化学方程式为______。
(2)烟气中的![]() 可以用NaOH溶液吸收,将所得的
可以用NaOH溶液吸收,将所得的![]() 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到![]() ,其原理如图所示。
,其原理如图所示。![]() 电极材料为石墨
电极材料为石墨![]()

①图中a极要连接电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,C口流出的物质是______。
极,C口流出的物质是______。
②![]() 放电的电极反应式为______。
放电的电极反应式为______。
(3)常温下,烟气中![]() 被NaOH溶液吸收可得到
被NaOH溶液吸收可得到![]() 、
、![]() 等。
等。
①已知![]() 水溶液显碱性,原因是______
水溶液显碱性,原因是______![]() 写出主要反应的离子方程式
写出主要反应的离子方程式![]() ,该溶液中
,该溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
②常温下,![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() ______
______![]() 填写准确数值
填写准确数值![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
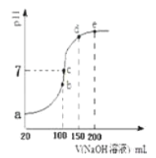
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是( )
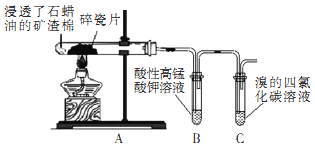
A.本实验能证明其产物含有碳碳不饱和键
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.实验完毕后先熄灭酒精灯后拆导管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表述正确的是![]()
①常温时![]() 的KOH溶液与
的KOH溶液与![]() 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液![]()
②二氧化硅是酸性氧化物,但它能与某种酸反应
③![]() ,
,![]() 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:![]()
⑥![]() 的燃烧热为
的燃烧热为![]() ,则表示
,则表示![]() 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为![]() 。
。
A.①④B.①②C.④⑥D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
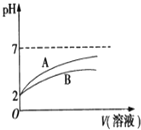
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com