
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
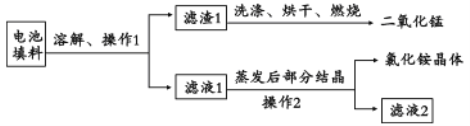
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:

用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
【答案】2MnO2+2H2O+2e-=2MnO(OH)+2OH- 增大接触面积,加快反应速率 过滤 除去二氧化锰中混有的碳粉 2MnOOH+6HCl(浓)= 2MnCl2+ Cl2↑+4 H2O 工艺流程简单;反应过程无有毒有害物质生成,不会造成二次污染;废物资源化;生成的产物CO2和H2O不会影响MnSO4的纯度 2.6×10-9 mol·L-1 6
【解析】
I.该原电池中正极上二氧化锰得电子发生还原反应;
II.废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水,溶解过滤后得到滤渣1为二氧化锰、碳粉,滤液为氯化铵和氯化锌,滤渣1洗涤烘干、灼烧除去碳得到二氧化锰,滤液1蒸发结晶过滤得到氯化铵晶体和滤液2;
(1)从化学反应速率的因素分析;过滤可以除去不溶于水的物质;玻璃棒的用途有搅拌、引流、转移物质等;加热条件下,炭粉能和空气中的氧气反应生成二氧化碳;
(2)①MnO(OH)与浓盐酸反应,+3价的锰能把浓盐酸氧化为氯气;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析;
(3)根据Ksp计算公式进行求解;
I.锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O═2MnO(OH)+Zn(OH)2,该原电池中正极上二氧化锰得电子发生还原反应,故答案为:2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
II.(1)①将电池填料研碎的目的是增大接触面积,加快反应速率,操作1和操作2的名称都是过滤。故答案为:增大接触面积,加快反应速率;过滤;
②灼烧滤渣l的目的是使炭粉和氧气反应转化成二氧化碳,从而和二氧化锰分离。故答案为:除去二氧化锰中混有的碳粉;
(2)①+3价的锰能把浓盐酸氧化为氯气,即MnO(OH)与浓盐酸反应生成氯气和氯化锰、水, 故答案为:![]() ;
;
②从可操作性、产品的纯度、对环境的影响等方面分析回收工艺的优点可知答案为:工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等;
(3)加碱调节pH为4,溶液中c(OH-)=10-10mol/L,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=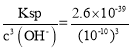 =2.6×10-9mol/L,如锌开始沉淀,则c(OH-)=
=2.6×10-9mol/L,如锌开始沉淀,则c(OH-)=![]() =10-8mol/L,此时pH=6,故答案为:2.6×10-9mol/L;6.
=10-8mol/L,此时pH=6,故答案为:2.6×10-9mol/L;6.


科目:高中化学 来源: 题型:
【题目】依据要求填空:
(1)羟基的电子式________________。
(2)![]() 含氧官能团的名称是________________。
含氧官能团的名称是________________。
(3)顺2丁烯的结构简式为________________。
(4)有机物![]() 按系统命名法命名为_________________________。
按系统命名法命名为_________________________。
(5) ![]() 的分子式为______________________。
的分子式为______________________。
(6)用系统命名法命名: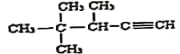 ____________________________。
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用离子方程式表示泡沫灭火器的灭火原理:______________
(2)25℃时,Ksp[Fe(OH)3]=2.79×10﹣39,该温度下反应Fe(OH)3+ 3H+ ![]() Fe3++ 3H2O的平衡常数K=_______
Fe3++ 3H2O的平衡常数K=_______
(3)在加热条件下 CeCl3 易发生水解,无水 CeCl3 可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中NH4Cl 的作用是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知![]() 的
的![]() ,则所有含有固体MgCO3的溶液中,都有
,则所有含有固体MgCO3的溶液中,都有![]() ,且
,且![]()
C.可通过比较![]() 和
和![]() 的Ksp的大小比较它们的溶解性
的Ksp的大小比较它们的溶解性
D.25 ℃时![]() ,故新生成的 AgCl可转化为AgI
,故新生成的 AgCl可转化为AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com