
ЁОЬтФПЁПЙЄвЕЗЯЦјЁЂЦћГЕЮВЦјХХЗХГіЕФ![]() ЁЂ
ЁЂ![]() ЕШЃЌЪЧаЮГЩЮэіВЕФживЊвђЫиЁЃіВЪЧгЩПеЦјжаЕФЛвГОЁЂСђЫсЁЂЯѕЫсЁЂгаЛњЬМЧтЛЏКЯЮяЕШСЃзгаЮГЩЕФбЬЮэЁЃ
ЕШЃЌЪЧаЮГЩЮэіВЕФживЊвђЫиЁЃіВЪЧгЩПеЦјжаЕФЛвГОЁЂСђЫсЁЂЯѕЫсЁЂгаЛњЬМЧтЛЏКЯЮяЕШСЃзгаЮГЩЕФбЬЮэЁЃ
(1)![]() КЭ
КЭ![]() дкПеЦјжаДцдкЯТСаЦНКтЃК
дкПеЦјжаДцдкЯТСаЦНКтЃК
![]() ЃЛ
ЃЛ
![]()
![]()

![]() ЭЈГЃдк
ЭЈГЃдк![]() ЕФДцдкЯТЃЌНјвЛВНБЛбѕЛЏЃЌЩњГЩ
ЕФДцдкЯТЃЌНјвЛВНБЛбѕЛЏЃЌЩњГЩ![]() ЁЃаДГі
ЁЃаДГі![]() КЭ
КЭ![]() ЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ______ЁЃ
ЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ______ЁЃ
(2)бЬЦјжаЕФ![]() ПЩвдгУNaOHШмвКЮќЪеЃЌНЋЫљЕУЕФ
ПЩвдгУNaOHШмвКЮќЪеЃЌНЋЫљЕУЕФ![]() ШмвКНјааЕчНтЃЌПЩбЛЗдйЩњNaOHЃЌЭЌЪБЕУЕН
ШмвКНјааЕчНтЃЌПЩбЛЗдйЩњNaOHЃЌЭЌЪБЕУЕН![]() ЃЌЦфдРэШчЭМЫљЪОЁЃ
ЃЌЦфдРэШчЭМЫљЪОЁЃ![]() ЕчМЋВФСЯЮЊЪЏФЋ
ЕчМЋВФСЯЮЊЪЏФЋ![]()

ЂйЭМжаaМЋвЊСЌНгЕчдДЕФ______![]() ЬюЁАе§ЁБЛђЁАИКЁБ
ЬюЁАе§ЁБЛђЁАИКЁБ![]() МЋЃЌCПкСїГіЕФЮяжЪЪЧ______ЁЃ
МЋЃЌCПкСїГіЕФЮяжЪЪЧ______ЁЃ
Ђк![]() ЗХЕчЕФЕчМЋЗДгІЪНЮЊ______ЁЃ
ЗХЕчЕФЕчМЋЗДгІЪНЮЊ______ЁЃ
(3)ГЃЮТЯТЃЌбЬЦјжа![]() БЛNaOHШмвКЮќЪеПЩЕУЕН
БЛNaOHШмвКЮќЪеПЩЕУЕН![]() ЁЂ
ЁЂ![]() ЕШЁЃ
ЕШЁЃ
ЂйвбжЊ![]() ЫЎШмвКЯдМюадЃЌдвђЪЧ______
ЫЎШмвКЯдМюадЃЌдвђЪЧ______![]() аДГіжївЊЗДгІЕФРызгЗНГЬЪН
аДГіжївЊЗДгІЕФРызгЗНГЬЪН![]() ЃЌИУШмвКжа
ЃЌИУШмвКжа![]() ______
______![]() ЬюЁА
ЬюЁА![]() ЁБЁА
ЁБЁА![]() ЁБЛђЁА
ЁБЛђЁА![]() ЁБ
ЁБ![]()
ЂкГЃЮТЯТЃЌ![]() ЕФ
ЕФ![]() ШмвКЕФ
ШмвКЕФ![]() ЃЌдђ
ЃЌдђ![]() ______
______![]() ЬюаДзМШЗЪ§жЕ
ЬюаДзМШЗЪ§жЕ![]()
ЁОД№АИЁП![]() ИК СђЫс
ИК СђЫс ![]()
![]()
![]()
![]()
ЁОНтЮіЁП
(1)ИљОнИЧЫЙЖЈТЩРДЧѓНтЃЛ
(2)ЂйдкЭМжагЩгкNa+ЯђaМЋЧјгђвЦЖЏЃЌИљОнЭЌжжЕчКЩЯрЛЅХХГтЃЌвьжжЕчКЩЯрЛЅЮќв§ЕФддђЃЌaвЊСЌНгЕчдДЕФИКМЋЃЌbвЊСЌНгЕчдДЕФе§МЋЃЌдкбєМЋЩЯSO32БфЮЊSO42ЃЌCПкСїГіЕФЮяжЪЪЧСђЫсЃЛ
ЂкдкбєМЋЩЯSO32БЛбѕЛЏЮЊSO42ЃЛ
(3)ЂйШмвКжаSO32ЫЎНтЃК![]() ЃЌЦЦЛЕЫЎЕФЕчРыЦНКтЃЌЕМжТШмвКЯдМюадЃЌИљОнЕчКЩЪиКуЗжЮіЃЛ
ЃЌЦЦЛЕЫЎЕФЕчРыЦНКтЃЌЕМжТШмвКЯдМюадЃЌИљОнЕчКЩЪиКуЗжЮіЃЛ
ЂкГЃЮТЯТЃЌбЧСђЫсЧтФЦГЪЫсадЃЌЫЕУїбЧСђЫсЧтИљРызгЕФЕчРыГЬЖШДѓгкЫЎНтГЬЖШЃЌИљОнЮяСЯЪиКуЕУ![]() (Na+)=
(Na+)=![]() (H2SO3)+
(H2SO3)+![]() (HSO3)+
(HSO3)+![]() (SO32)ЂйЃЌИљОнЕчКЩЪиКуЕУ
(SO32)ЂйЃЌИљОнЕчКЩЪиКуЕУ![]() (Na+)+
(Na+)+![]() (H+)=
(H+)=![]() (OH)+
(OH)+![]() (HSO3)+2
(HSO3)+2![]() (SO32)ЂкЃЌСНЪНМЦЫуЕУЕНЁЃ
(SO32)ЂкЃЌСНЪНМЦЫуЕУЕНЁЃ
![]() ИљОнИЧЫЙЖЈТЩРДЧѓНтЃЌЂй
ИљОнИЧЫЙЖЈТЩРДЧѓНтЃЌЂй![]() ЃЛЂк
ЃЛЂк![]() ШЛКѓгУ(Ђк-Ђй)
ШЛКѓгУ(Ђк-Ђй)![]() ЕУЃК
ЕУЃК![]() ЃЛ
ЃЛ
(2)ЂйИљОнЕчНтГижавѕбєРызгЕФвЦЖЏЗНЯђЃКбєРызгвЦЯђвѕМЋПЩвдХаЖЯЂйЭМжаaМЋвЊСЌНгЕчдДЕФИКМЋЃЌ![]() дкбєМЋЪЇШЅЕчзгБфГЩ
дкбєМЋЪЇШЅЕчзгБфГЩ![]() ЃЌЫљвдCПкСїГіЕФЮяжЪЪЧ
ЃЌЫљвдCПкСїГіЕФЮяжЪЪЧ![]() ЃЛ
ЃЛ
Ђк![]() ЪЇШЅЕчзгБЛбѕЛЏГЩ
ЪЇШЅЕчзгБЛбѕЛЏГЩ![]() ЃЌЕчМЋЗДгІЪНЮЊЃК
ЃЌЕчМЋЗДгІЪНЮЊЃК![]() ЃЛ
ЃЛ
(3)ЂйШмвКжа![]() ЫЎНтЃК
ЫЎНтЃК![]() ЃЌЦЦЛЕЫЎЕФЕчРыЦНКтЃЌЕМжТШмвКЯдМюадЃЌИљОнЕчКЩЪиКуЃЌШмвКжа
ЃЌЦЦЛЕЫЎЕФЕчРыЦНКтЃЌЕМжТШмвКЯдМюадЃЌИљОнЕчКЩЪиКуЃЌШмвКжа![]() ЃЌЙЪ
ЃЌЙЪ![]() ЃЛ
ЃЛ
ЂкГЃЮТЯТЃЌбЧСђЫсЧтФЦГЪЫсадЃЌЫЕУїбЧСђЫсЧтИљРызгЕФЕчРыГЬЖШДѓгкЫЎНтГЬЖШЃЌИљОнЮяСЯЪиКуЕУЂй![]() ЃЌИљОнЕчКЩЪиКуЕУЂк
ЃЌИљОнЕчКЩЪиКуЕУЂк![]() ЃЌНЋЗНГЬЪНЂйДњШыЂкЕУЃЌ
ЃЌНЋЗНГЬЪНЂйДњШыЂкЕУЃЌ![]() ЃЌЫљвд
ЃЌЫљвд![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаЙњДЋЭГЮФЛЏЖдШЫРрЮФУїЙБЯзОоДѓЁЃЯТСаЙХДњЮФЯзжагаЙиЛЏбЇЯжЯѓМЧдиКЯРэЕФЪЧ( )
A.РюАзЕФЪЋОфЁАШеееЯуТЏЩњзЯбЬЃЌвЃПДЦйВМЙвЧАДЈЁБЃЌжЛЩцМАЛЏбЇБфЛЏ
B.ЫещјЕФЪЋОфЁАРцЛЈЕАзСјЩюЧрСјаѕЗЩЪБЛЈТњГЧЁБжаЃЌСјаѕЕФжївЊГЩЗжЪЧЕААзжЪ
C.ЖЋНњ![]() БЇЦгзг
БЇЦгзг![]() жаЕФЁАЕЄЩА
жаЕФЁАЕЄЩА![]() ЩежЎГЩЫЎвјЃЌЛ§БфгжГЩЕЄЩАЁБЃЌУшЪіЕФЪЧПЩФцЗДгІ
ЩежЎГЩЫЎвјЃЌЛ§БфгжГЩЕЄЩАЁБЃЌУшЪіЕФЪЧПЩФцЗДгІ
D.ФЯББГЏ![]() БОВнОМЏзЂ
БОВнОМЏзЂ![]() жаЕФЁАвдЛ№ЩежЎЃЌзЯЧрбЬЦ№ЃЌдЦЪЧецЯѕЪЏвВЁБЃЌУшЪіЕФЪЧгУбцЩЋЗДгІМьбщЯѕЫсМи
жаЕФЁАвдЛ№ЩежЎЃЌзЯЧрбЬЦ№ЃЌдЦЪЧецЯѕЪЏвВЁБЃЌУшЪіЕФЪЧгУбцЩЋЗДгІМьбщЯѕЫсМи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)гУРызгЗНГЬЪНБэЪОХнФУ№Л№ЦїЕФУ№Л№дРэЃК______________
(2)25ЁцЪБЃЌKsp[Fe(OH)3]=2.79ЁС10Љ39ЃЌИУЮТЖШЯТЗДгІFe(OH)3+ 3H+ ![]() Fe3++ 3H2OЕФЦНКтГЃЪ§K=_______
Fe3++ 3H2OЕФЦНКтГЃЪ§K=_______
(3)дкМгШШЬѕМўЯТ CeCl3 взЗЂЩњЫЎНтЃЌЮоЫЎ CeCl3 ПЩгУМгШШ CeCl3ЁЄ6H2O КЭ NH4Cl ЙЬЬхЛьКЯЮяЕФЗНЗЈРДжЦБИЁЃЦфжаNH4Cl ЕФзїгУЪЧ____________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЯђAgClБЅКЭШмвКжаМгШыNaClЙЬЬхЃЌc(Cl-)діДѓЃЌKspдіДѓ
B.вбжЊ![]() ЕФ
ЕФ![]() ЃЌдђЫљгаКЌгаЙЬЬхMgCO3ЕФШмвКжаЃЌЖМга
ЃЌдђЫљгаКЌгаЙЬЬхMgCO3ЕФШмвКжаЃЌЖМга![]() ЃЌЧв
ЃЌЧв![]()
C.ПЩЭЈЙ§БШНЯ![]() КЭ
КЭ![]() ЕФKspЕФДѓаЁБШНЯЫќУЧЕФШмНтад
ЕФKspЕФДѓаЁБШНЯЫќУЧЕФШмНтад
D.25 ЁцЪБ![]() ЃЌЙЪаТЩњГЩЕФ AgClПЩзЊЛЏЮЊAgI
ЃЌЙЪаТЩњГЩЕФ AgClПЩзЊЛЏЮЊAgI
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЕчНтжЪШмвКЕФЫЕЗЈе§ШЗЕФЪЧ
A. ГЃЮТЯТЃЌ0.1 mol/L Na2SШмвКжаДцдкЃКc(OHЃ)=c(H+)+c(HSЃ)+c(H2S)
B. pHЯрЭЌЕФЂйCH3COONaЁЂЂкNaHCO3ЁЂЂлNaClOШ§жжШмвКЕФc(Na+)ЃКЂй>Ђк>Ђл
C. 0.1mol/L NaHCO3ШмвКгы0.1mol/L NaOHШмвКЕШЬхЛ§ЛьКЯЃЌЫљЕУШмвКжаЃКc(NaЃЋ)>c(CO32Ѓ)>c(HCO3Ѓ)>c(OHЃ) >c(H+)
D. Яђ0.1 molЁЄLЃ1ЕФАБЫЎжаМгШыЩйСПСђЫсяЇЙЬЬхЃЌдђШмвКжаc(OHЃ)/ c(NH3ЁЄH2O)діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк2LЕФКуШнУмБеШнЦїжаГфШы2mol SO2КЭ1mol O2ЃЌЗЂЩњЗДгІЃК2SO2ЃЈgЃЉ+O2ЃЈgЃЉ![]() 2SO3ЃЈgЃЉЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
2SO3ЃЈgЃЉЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A.гЩЭМЂйПЩжЊЃКИУЗДгІЕФЁїHЃО0
B.дкЭМЂкжаЕФt1ЪБГфШыЩйСПыВЦјЃЌШнЦїФкбЙЧПдіДѓЃЌЦНКтгввЦ
C.ЭМЂлЫљЪОЬѕМўЯТЃЌЦНКтГЃЪ§ЮЊ2
D.ЭМЂмжаЕФyПЩвдБэЪОЦНКтГЃЪ§ЛђУмЖШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎЖўМзУбЪЧвЛжжживЊЕФЧхНрШМСЯЃЎКЯГЩЖўМзУбЪЧНтОіФмдДЮЃЛњЕФбаОПЗНЯђжЎвЛЃЎ
ЃЈ1ЃЉгУCO2КЭH2ПЩвдКЯГЩЖўМзУбЃЈCH3OCH3ЃЉ
вбжЊЃКCOЃЈgЃЉ+2H2ЃЈgЃЉЈTCH3OHЃЈgЃЉЁїH1=Љ90.1kJ/mol
COЃЈgЃЉ+H2OЃЈgЃЉЈTCO2ЃЈgЃЉ+H2ЃЈgЃЉЁїH2=Љ41.1kJ/mol
2CH3OHЃЈgЃЉЈTCH3OCH3ЃЈgЃЉ+H2OЃЈgЃЉЁїH3=Љ24.5kJ/mol
дђЗДгІ2CO2ЃЈgЃЉ+6H2ЃЈgЃЉЈTCH3OCH3ЃЈgЃЉ+3H2OЃЈgЃЉЁїH=____________ЃЎ
ЃЈ2ЃЉЖўМзУбЃЈCH3OCH3ЃЉШМСЯЕчГиПЩвдЬсЩ§ФмСПРћгУТЪЃЎРћгУЖўМзУбЫсадНщжЪШМСЯЕчГиЕчНт200mLБЅКЭЪГбЮЫЎЃЈЖшадЕчМЋЃЉЃЌЕчНтвЛЖЮЪБМфКѓЃЌвѕМЋЪеМЏЕНБъПіЯТЕФЧтЦј2.24LЃЈЩшЕчНтКѓШмвКЬхЛ§ВЛБфЃЉ
ЂйЖўМзУбШМСЯЕчГиЕФе§МЋЗДгІЪНЮЊ_____________________________ЃЎ
ЂкЧыаДГіЕчНтЪГбЮЫЎЕФЛЏбЇЗНГЬЪН____________________ЃЎ
ЂлЕчНтКѓШмвКЕФpH=_________ЃЎ
IIЃЎЪвЮТЯТЃЌ0.1 molЁЄLЃlЕФKOHШмвКЕЮ10.00mL 0.10 molЁЄLЃl H2C2O4 (ЖўдЊШѕЫсЃЉШмвКЃЌЫљЕУЕЮЖЈЧњЯпШчЭМ(ЛьКЯШмвКЕФЬхЛ§ПЩПДГЩЛьКЯЧАШмвКЕФЬхЛ§жЎКЭ)ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
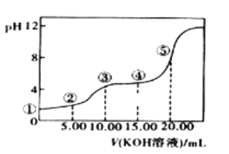
ЃЈ3ЃЉЕуЂлЫљЪОШмвКжаЫљгаРызгЕФХЈЖШгЩДѓЕНаЁЕФЫГађЮЊЃК___________________ЁЃЕуЂмЫљЪОШмвКжаЃКc(K+)+c(H2C2O4)+c(HC2O4Ѓ)+c(C2O422-)ЃН________mol/LЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНЪщаДе§ШЗЕФЪЧ
A. вбжЊМзЭщЕФШМЩеШШЮЊ890.3 kJmol-1ЃЌдђМзЭщШМЩеЕФШШЛЏбЇЗНГЬЪНПЩБэЪОЮЊЃКCH4(g)ЃЋ2O2(g)ЃНCO2(g)ЃЋ2H2O(g) ІЄHЃНЃ890.3 kJmol-1
B. вбжЊЧПЫсКЭЧПМюЕФЯЁШмвКЗДгІЕФжаКЭШШЮЊ57.3 kJmol-1ЃЌдђCH3COOHЃЋOHЁЊЃНCH3COOЁЊЃЋH2O ІЄHЃНЃ57.3 kJmol-1
C. вЛЖЈЬѕМўЯТЃЌНЋ0.5mol N2КЭ1.5mol H2жУгкУмБеШнЦїжаЃЌГфЗжЗДгІЩњГЩNH3(g)ЃЌЗХГіШШСП19.3kJЃЌЦфШШЛЏбЇЗНГЬЪНЮЊЃКN2(g)ЃЋ3H2(g)![]() 2NH3(g) ІЄHЃНЃ38.6 kJmol-1
2NH3(g) ІЄHЃНЃ38.6 kJmol-1
D. вбжЊ1g N2H4(l)КЭзуСПH2O2(l)ЗДгІЩњГЩЕЊЦјКЭЫЎеєЦјЃЌЗХГіШШСП20.05kJЃЌИУШШЛЏбЇЗНГЬЪНПЩБэЪОЮЊЃКN2H4(l)ЃЋ2H2O2(l)ЃНN2(g)ЃЋ4H2O(g) ІЄHЃНЃ641.6 kJmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЫФжжВЛЭЌЖбЛ§ЗНЪНЕФН№ЪєОЇЬхЕФОЇАћШчЭМЫљЪОЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A. ЂйЮЊМђЕЅСЂЗНЖбЛ§ЃЌЂкЮЊУОаЭЃЌЂлЮЊМиаЭЃЌЂмЮЊЭаЭ
B. УПИіОЇАћКЌгаЕФдзгЪ§ЗжБ№ЮЊЃКЂй1ИіЃЌЂк2ИіЃЌЂл2ИіЃЌЂм4Иі
C. ОЇАћжадзгЕФХфЮЛЪ§ЗжБ№ЮЊЃКЂй6ЃЌЂк8ЃЌЂл8ЃЌЂм12
D. ПеМфРћгУТЪЕФДѓаЁЙиЯЕЮЊЃКЂйЃМЂкЃМЂлЃМЂм
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com