
【题目】下列说法或表述正确的是![]()
①常温时![]() 的KOH溶液与
的KOH溶液与![]() 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液![]()
②二氧化硅是酸性氧化物,但它能与某种酸反应
③![]() ,
,![]() 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:![]()
⑥![]() 的燃烧热为
的燃烧热为![]() ,则表示
,则表示![]() 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为![]() 。
。
A.①④B.①②C.④⑥D.③⑤
科目:高中化学 来源: 题型:
【题目】已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
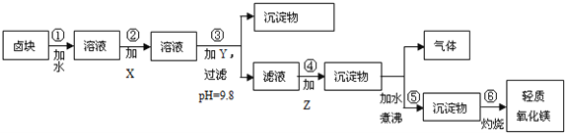
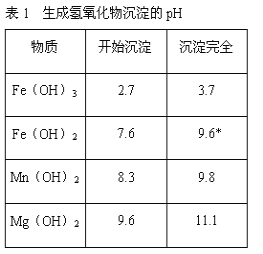
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
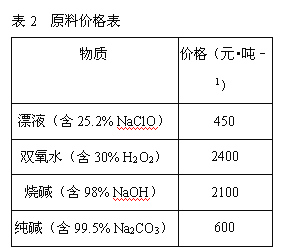
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂采用稀NaOH溶液脱除![]() 。若碱洗脱除后所得废液的pH约为
。若碱洗脱除后所得废液的pH约为![]() 已知:相同温度下饱和
已知:相同温度下饱和![]() 溶液的pH约为
溶液的pH约为![]() ,则下列说法正确的是
,则下列说法正确的是
A.该溶液中:![]()
B.该溶液中:![]()
C.加水稀释该溶液,恢复至原温度,pH增大,![]() 不变
不变
D.该溶液pH约为13的原因:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com