
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________,装置B的作用是________。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________。装置D中滴有几滴淀粉溶液,其作用是________________。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________,氧化产物是___________。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________。
②进入装置D中的ClO2质量为_______,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,实验开始时先闭合K1,断开K2。一段时间后,再断开K1,闭合K2,电流表指针偏转,同时A极质量减轻。下列说法不正确的是

A. 闭合K1,断开K2后,B极:Ag-e-=Ag+
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO3-从甲池进入乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法不正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 原子半径:r(A)<r(C)<r(B)
C. 甲、乙可能都具有漂白性
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(水)、H(紫色石蕊试液)
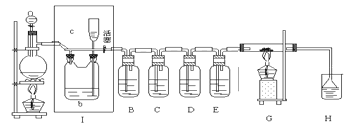
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:________
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B________;D________请写出C中发生反应的化学方程式________
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式________。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是________。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作________;装置Ⅰ中的现象是________。
(6)若将E中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3 , 其物质的量比为1:2,则氧化剂和还原剂的物质的量之比为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数数的值,下列说法不正确的是( )
A.标准状况下,1.8gH2O中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含质子总数为7NA
C.含0.2molH2SO4的浓硫酸与足量Mg反应,转移电子数为0.2NA
D.足量Fe在0.1molCl2中充分燃烧,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2===2CO2+4H2O。下列有关该电池的说法错误的是( )
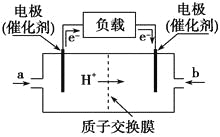
A. 右边的电极为电池的负极,b处通入的是空气
B. 左边的电极为电池的负极,a处通入的是甲醇
C. 电池负极的反应式为:2CH3OH+2H2O-12e-===2CO2↑+12H+
D. 电池正极的反应式为:3O2+12H++12e-===6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com