
【题目】如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(水)、H(紫色石蕊试液)
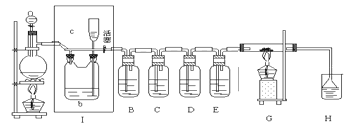
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:________
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B________;D________请写出C中发生反应的化学方程式________
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式________。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是________。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作________;装置Ⅰ中的现象是________。
(6)若将E中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3 , 其物质的量比为1:2,则氧化剂和还原剂的物质的量之比为:________。
【答案】MnO2+4HCl ![]() MnCl2+2H2O+Cl2↑ 产生白色沉淀 溶液变蓝 2FeCl2+Cl2=2FeCl3 C+2H2O+Cl2
MnCl2+2H2O+Cl2↑ 产生白色沉淀 溶液变蓝 2FeCl2+Cl2=2FeCl3 C+2H2O+Cl2![]() CO2+4HCl 生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去 关闭Ⅰ处活塞 Ⅰ处b瓶内页面下降,c中液面上升 11:3
CO2+4HCl 生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去 关闭Ⅰ处活塞 Ⅰ处b瓶内页面下降,c中液面上升 11:3
【解析】
(1)MnO2与浓盐酸反应生成MnCl2、H2O和Cl2;
(2)根据氯气的性质和氯水的成分确定实验现象;
(3)根据实验现象确定产物,进而得出反应的化学方程式;
(4)先变红是由于酸性气体产生,再变无色是由于漂白作用,据此分析;
(5)实验结束后,由于余热作用产生的氯气应进行收集或吸收;
(6)根据得失电子守恒进行计算。
(1)MnO2与浓盐酸反应生成MnCl2、H2O和Cl2 , 该反应的化学方程式为:MnO2+4HCl![]() MnCl2+2H2O+Cl2
MnCl2+2H2O+Cl2![]() ;
;
(2)氯气溶于水后产生HCl和HClO,其中Cl-能与Ag+结合成AgCl沉淀,故B中现象为产生白色沉淀;由于氯气具有氧化性,能将I-氧化成I2 , 淀粉遇碘变蓝色,故D中的现象为溶液变为蓝色;氯气具有氧化性,C中Fe2+具有还原性,二者可发生氧化还原反应,该反应的化学方程式为:2FeCl2+Cl2=2FeCl3;
(3)“ 一种产物能使H处紫色石蕊试液变红 ”则说明该产物的水溶液显酸性,结合元素守恒可知,产物为HCl;“ 另一产物能使澄清石灰水变浑浊 ”则该产物为CO2 , 故该反应的化学方程式为:C+2H2O+Cl2![]() CO2+4HCl;
CO2+4HCl;
(4)实验过程中生成的HCl使紫色石蕊试液变红色;剩余的氯气又与水作用生成HClO,具有漂白作用,使红色褪去;
(5)实验结束后,由于余热会继续产生氯气,此时应关闭Ⅰ中活塞,产生的氯气不通过后续装置,防止造成空气污染;此时可观察到Ⅰ中b瓶内液面下降,c中液面上升;
(6)该反应中氯气既是氧化剂又是还原剂。反应生成NaClO和NaClO3的物质的量之比为1:2,设其物质的量分别为1mol和2mol,则其失去的电子数为:1mol×1+2mol×5=11mol,故还原剂的物质的量为![]() ;根据得失电子守恒可得,反应过程中,氧化剂得到的电子数也为11mol,故氧化剂的物质的量为
;根据得失电子守恒可得,反应过程中,氧化剂得到的电子数也为11mol,故氧化剂的物质的量为![]() ;因此氧化剂和还原剂的物质的量之比为
;因此氧化剂和还原剂的物质的量之比为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)A分子的空间构型为___________。
(2)B的名称是___________。
(3)D的分子式是___________。
(4)C、E的关系是___________(填“同系物”或“同分异构体”或“同一种物质”)。
(5)A~E表示的物质中,能发生加成反应的两种物质是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属氧化物都是碱性氧化物
B. 溶于水电离出H+的物质都是酸
C. 在氧化还原反应中,金属单质作反应物时一定是还原剂
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硫酸中,过滤、除去杂质,在滤液中加入适量硝酸,再加入适量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红褐色的残渣。上述沉淀和残渣分别为( )
A.Fe(OH)3、Fe2O3B.Fe(OH)2、FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4D.Fe2O3、Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH== -889.6kJ/mol。请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量___________(填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
(4)如图所示的装置是由CH4 、O2和KOH溶液组成的新型燃料电池。
①该电池的负极是______(填“a”或“b”)电极,该极的电极反应式是_____。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com