
����Ŀ����Ȼ������Ҫ�ɷּ���ȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�ǣ�CH4(g) + 2O2(g) == CO2(g) + 2H2O��l�� ��H== ��889.6kJ/mol����ش��������⣺
��1����Ӧ�������ܺ�________������ڡ�����С�ڡ����ڡ��������������ܺ͡�
��2����1 mol������ȫȼ�����ɶ�����̼��ˮ��������ų�������___________���������������������889.6kJ��
��3����֪����ȼ������Һ̬ˮ���Ȼ�ѧ����ʽ�ǣ�2H2(g)+O2(g) ===2H2O��l�� ��H =��572kJ/mol ������ͬ�����ļ������������ȫȼ������Һ̬ˮ�����Ƚ϶����________��
��4����ͼ��ʾ��װ������CH4 ��O2��KOH��Һ��ɵ�����ȼ�ϵ�ء�
�ٸõ�صĸ�����______(�a����b��)�缫���ü��ĵ缫��Ӧʽ��_____��
�ڵ�ع���һ��ʱ���������Һ��pH________(���������С�����䡱)��

���𰸡����� < ���� a CH4��10OH����8e��===CO32����7H2O ��С
��������
��1����֪CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��889.6kJ/mol����Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ�������ܺʹ��������������ܺͣ��ʴ�Ϊ�����ڣ�
��2��ˮ����ת��ΪҺ̬ˮҪ�ų�����������1mol������ȫȼ�����ɶ�����̼��ˮ�������ų�������С��889.6kJ���ʴ�Ϊ������
��3����֪CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��889.6kJ/mol��2H2��g��+O2��g��=2H2O��H=��572kJ/mol����1g������ȫȼ�շų�������Ϊ![]() ��889.6kJ=55.6kJ��1g������ȫȼ�շų�������Ϊ
��889.6kJ=55.6kJ��1g������ȫȼ�շų�������Ϊ![]() ��572kJ=143kJ��������ͬ�����ļ������������ȫȼ������Һ̬ˮ�������ŵ������϶࣬�ʴ�Ϊ��������
��572kJ=143kJ��������ͬ�����ļ������������ȫȼ������Һ̬ˮ�������ŵ������϶࣬�ʴ�Ϊ��������
��4���ٸõ�صĸ�����CH4���缫aΪ����������������Ӧ���缫��ӦʽΪ��CH4+10OH����8e���TCO32��+7H2O���ʴ�Ϊ��a��CH4��10OH����8e��===CO32����7H2O��
���ܵĵ缫��ӦʽΪCH4+2OH��+2O2=CO32��+3H2O�����ܵĵ缫��Ӧʽ��֪�����������Ӳ��ϱ����ģ��ҷ�Ӧ������ˮ�������������ӵ�Ũ�ȼ�С��������Һ��pHֵ��С���ʴ�Ϊ����С��


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����һ����ȡ������������Ϊԭ�Ͻ����ض���Ӧ��װ�ã����и��Լ�ƿװ���Լ�Ϊ��B��AgNO3��Һ����C���Ȼ�������Һ����D���⻯�ص�����Һ����E��ˮ����H����ɫʯ����Һ��
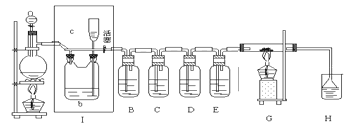
��1��A����������װ�ã�������ƿ��ʢ��MnO2���壬�仯ѧ��Ӧ����ʽ�ǣ�________
��2��ʵ�鿪ʼʱ���ȵ�ȼA���ƾ��ƣ���Һ©�������͢�������������������װ�ã��ٵ�ȼG���ƾ��ƣ��ش��������⣺
����װ���е�������B________��D________��д��C�з�����Ӧ�Ļ�ѧ����ʽ________
��3����Gװ�õ�Ӳ�ʲ�������ʢ��̼�ۣ�����������ԭ��Ӧ��һ�ֲ�����ʹH����ɫʯ����Һ��죬��һ������ʹ����ʯ��ˮ����ǣ�д��G�еķ�Ӧ�Ļ�ѧ����ʽ________��
��4����H������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ����ԭ����________��
��5��G����Ӧ��Ϻ�رշ�Һ©����������ȥ�ƾ��ƣ����������ȵ����ã�A������������������ʱӦ����������________��װ�â��е�������________��
��6������E�е�ˮ��������������Һ����Һ�в�����NaClO����NaClO3 �� �����ʵ�����Ϊ1��2�����������ͻ�ԭ�������ʵ���֮��Ϊ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mL 0.5 mol/L Na2CO3��Һ��ȡ��10 mL������ˮϡ�͵�250 mL����ϡ�ͺ���Һ��Na2CO3�����ʵ���Ũ��Ϊ
A. 0.5 mol/L B. 0.2 mol/L C. 0.05 mol/L D. 0.02 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)�����Ȼ�������諻�������������ҩƷ��Ⱦ�ϡ�������Լ��ȡ��й����ʵIJ����������±���

ʵ�����ø���������Ķ�������������ϳ������ȣ���Ӧ���Ȼ�ѧ����ʽΪ��SO2(g)+Cl2(g) ![]() SO2Cl2(l) ��H=��97.3 kJ��mol-1��Ӧװ����ͼ��ʾ(�г�������ʡ��)����ش��й����⣺
SO2Cl2(l) ��H=��97.3 kJ��mol-1��Ӧװ����ͼ��ʾ(�г�������ʡ��)����ش��й����⣺

(1)����A������Ϊ___________________��
(2)����B��������_____________________��
(3)װ�ñ���ʢ�ŵ��Լ�Ϊ____________����ʵ�����������������ն��������ȵ����ӷ�Ӧ����ʽΪ___________________��
(4)Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������_________(�����)
����ͨ����ˮ����ͨ����
�ڿ����������ʣ��������˿�
����������ƿ���̣����ʵ�����
�ܼ���������ƿ
(5)����������Ҳ�����Ȼ���(ClSO3H)�ֽ��ã��÷�Ӧ�Ļ�ѧ����ʽΪ��
2ClSO3H��H2SO4+SO2Cl2���˷����õ��IJ�Ʒ�л�������ᡣ
�ٴӷֽ�����з���������ȵ�ʵ���������Ϊ__________________��
�������ʵ�鷽�������Ȼ���ֽ���ȡ�����Ȳ�Ʒ�л�������(��ѡ�Լ���ϡ���ᡢϡ���ᡢBaCl2��Һ������ˮ����ɫʯ����Һ)__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��˾���������ıʼDZ��������õļ״�ȼ�ϵ�صĹ���ʾ��ͼ���״��ڴ����������ṩ����(H��)�͵��ӣ����Ӿ�����·�����Ӿ��ڵ�·������һ����������Ӧ���õ���ܷ�ӦʽΪ��2CH3OH��3O2===2CO2��4H2O�������йظõ�ص�˵���������( )
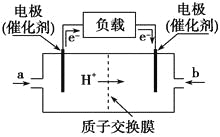
A. �ұߵĵ缫Ϊ��صĸ�����b��ͨ����ǿ���
B. ��ߵĵ缫Ϊ��صĸ�����a��ͨ����Ǽ״�
C. ��ظ����ķ�ӦʽΪ��2CH3OH��2H2O��12e��===2CO2����12H��
D. ��������ķ�ӦʽΪ��3O2��12H����12e��===6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��Ӧ�е������仯,���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ���¡���ͼΪN2(g)��O2(g)����NO(g)�����е������仯��

��1������ͨ���Ѳ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ������N��N���ļ���Ϊ_________________kJ��mol-1��������ͼд��N2(g)��O2(g)����NO(g)���Ȼ�ѧ����ʽ��________________________________��
��2��NO(g)�ֽ�����N2(g)��O2(g)���Ȼ�ѧ����ʽΪ��_____________________������16 g O2(g)����ʱ,�÷�Ӧ�зų�������Ϊ��_________________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��C��N��Si�Ǽ��ֳ�������Ҫ�ǽ���Ԫ�أ����γɵĸ��ֻ���������Ȼ���й㷺���ڡ�
(1)��̬��ԭ�ӵĵ����Ų�ʽΪ________________��C��N��OԪ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ________________��д��һ����CO32-��Ϊ�ȵ�����������ӣ�_________��
(2)BF3��һ������ˮ���γ���ͼ��ʾ����R

�پ���R�и���������������漰___________(����ĸ����)��
a.���Ӽ� b.���ۼ� c.��λ�� d.������ e.���»���
�ھ���R�������ӵĿռ乹��Ϊ________________________��
(3)�Ҷ���(H2NCH2CH2NH2)��CuCl2��Һ���γ�������(�ṹ��ͼ��ʾ)���Ҷ��������е�ԭ�ӵ��ӻ�����Ϊ________________��
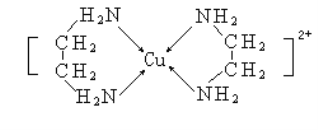
�Ҷ��������װ�[N(CH3)3]�����ڰ������Ҷ��������װ��ķе�ߵö࣬��ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ʵ���ҳ���MnO2 ��Ũ���ᷴӦ�Ʊ�Cl2��װ����ͼ��ʾ����

��1���Ʊ�ʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ��������ǣ�________������ţ���
������ƿ�м���MnO2��ĩ ������ ������ƿ�м���Ũ����
��2��д��Բ����ƿ�з�����Ӧ�����ӷ���ʽ___________________��
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȡ���ͬѧ������о��巽�������������ʵ�鷽����ѡ�������ʵ�鷽��________�����ţ���
a����Cl-ת��ΪAgCl���������ˣ�ϴ�ӣ������������������
b��������NaHCO3���巴Ӧ������Ӧ������ֱ���ü�ʯ�����գ��ⶨ���ɵ����������
c��������п��Ӧ���������������״���µ����
��. Ϊ�ⶨij����������Ʒ���ȣ��о�С����������װ�ã�װ��ͼ�мг�������ʡ�ԣ�����ʵ�顣��Ӧ��ȫ��ȡC����Һ���������BaCl2��Һ�����ˡ� ������ ����������������������ݼ�����Ʒ���ȡ���ش�

��1����������������_________��
��2��װ��B��������_________��
��3������ʵ���õ���Ʒ���ȱ�ʵ��ƫ�ͣ�Ϊ��߲ⶨ�����ȷ�ȣ����װ�ÿɲ�ȡ�ĸĽ���ʩ��____________________(д���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ҫ��ҽҩ�м��壬��A��BΪԭ�Ϻϳɱ�����������F��·������:

��1��A����ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ__________��д��A+B��C�Ļ�ѧ��Ӧ����ʽ��____________��
��2��E����2����C���ɵĺ���3����Ԫ���Ļ����E�����в�ͬ��ѧ��������ԭ����____�֡�
��3��D��F�ķ�Ӧ������______��д����������������F������ͬ���칹��(�����������칹)�Ľṹ��ʽ:__________________��
������һԪ���������ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com