
【题目】(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+ 2KNO3+ 3C![]() 3CO2↑+ A + N2↑(已配平)
3CO2↑+ A + N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为__________。
②生成物A的晶体类型为__________,含极性共价键的分子的中心原子轨道杂化类型为_______。
③已知CN-与N2结构相似,推算HCN分子中![]() 键与
键与![]() 键数目之比为____________。
键数目之比为____________。
(2)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(3)下列有关说法正确的是______________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图

D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,试写出反应的离子方程式:_______。
(5)氮化硼形成立方晶体,晶体结构类似金刚石,如图所示。
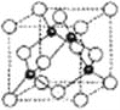
已知:该晶体密度为ρg·㎝-3,NA代表阿伏加德罗常数的值。
①该晶体的化学式为______________。
②在该晶体中,B与N形成共价键的键长(d)为________________________pm(列式即可)。
【答案】O>N>C>K 离子晶体 sp 1∶1 GaF3是离子晶体,GaCl3是分子晶体,离子晶体熔沸点较高 AD Cu2++ 4NH3·H2O=[Cu(NH3)4]2++4H2O BN ![]() ×
×![]() ×1010
×1010
【解析】
(1)①钾为活泼金属,电负性比较小,同一周期元素随着原子序数增大其电负性增大;②根据元素守恒、原子守恒知,A为K2S,由阴阳离子构成的晶体为离子晶体;含有极性共价键的分子为CO2,该分子中C原子价层电子对数是2,根据价层电子对互斥理论判断C原子杂化类型;③CN-与N2为等电子体,结构相似,则C、N原子之间存在共价三键,共价单键为σ键,共价三键中含有1个σ键、2个π键,据此分析解答;
(2)离子晶体熔沸点较高、分子晶体熔沸点较低;
(3)A.根据元素在周期表中的位置判断;B.N的2p能级半充满、较稳定;C.图中堆积方式为六方最密堆积,为镁型;D.元素的电负性越大,金属性越弱,据此分析判断;
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,生成[Cu(NH3)4]2+,据此书写反应的离子方程式;
(5)①利用均摊法计算晶胞中各原子数目,进而确定该晶体的化学式;②B与N连线处于晶胞体对角线上,且形成共价键的键长为体对角线长度的![]() ,根据晶胞中原子数目计算晶胞质量,结合密度计算晶胞体积,进而计算晶胞棱长,和晶胞体对角线长度。
,根据晶胞中原子数目计算晶胞质量,结合密度计算晶胞体积,进而计算晶胞棱长,和晶胞体对角线长度。
(1)①钾为活泼金属,电负性比较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大,所以电负性O>N>C>K,故答案为:O>N>C>K;
②根据原子守恒知A为K2S,该物质是由钾离子和硫离子构成的,属于离子晶体;产物中含极性共价键的分子为CO2,C原子的价层电子对数是2,且不含孤电子对,则其空间构型为直线形,中心原子轨道杂化类型为sp,故答案为:离子晶体;sp;
③HCN中CN-与N2结构相同,HCN的结构为H-C≡N,含有2个σ键和2个π键,分子中σ键与π键数目之比为2∶2=1∶1,故答案为:1∶1;
(2)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高,故答案为:GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;
(3)A.由元素在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;B.O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,即氮的第一电离能比氧的第一电离能大,故B错误;C.图中堆积方式六方最密堆积,为镁型,不是体心立方堆积(钾型),故C错误;D.元素的电负性越大,金属性越弱,锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强,故D正确;故答案为:AD;
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,反应的离子方程式为Cu2++ 4NH3·H2O=[Cu(NH3)4]2++4H2O,故答案为:Cu2++ 4NH3·H2O=[Cu(NH3)4]2++4H2O;
(5)①晶胞中黑色球处于晶胞内部,晶胞中黑色球数目为4,白色球处于晶胞顶点与面心,晶胞中白色球数目为8×![]() +6×
+6×![]() =4,故白色球与黑色球数目之比为1∶1,可确定该晶体的化学式为BN,故答案为:BN;
=4,故白色球与黑色球数目之比为1∶1,可确定该晶体的化学式为BN,故答案为:BN;
②晶胞质量为(4×![]() )g=
)g=![]() g,则晶胞棱长=
g,则晶胞棱长=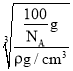 =
=![]() cm=
cm=![]() ×1010pm,B与N连线处于晶胞体对角线上,且形成共价键的键长为体对角线长度的
×1010pm,B与N连线处于晶胞体对角线上,且形成共价键的键长为体对角线长度的![]() ,故形成共价键的键长d=
,故形成共价键的键长d=![]() ×
×![]() ×
×![]() ×1010pm=
×1010pm=![]() ×
×![]() ×1010pm,故答案为:
×1010pm,故答案为:![]() ×
×![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
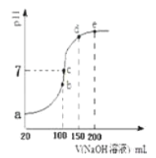
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。

下列说法正确的是
A.室温时,HA的电离度约为10-6
B.图中B点时,溶液的Kw略大于1×10-14
C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-)
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备![]() 的反应:
的反应:![]() ,在体积为1L的恒容密闭容器中,充2molCO和
,在体积为1L的恒容密闭容器中,充2molCO和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
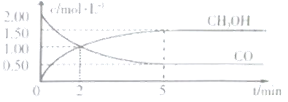
①从反应开始到5min,用一氧化碳表示的平均反应速率υ(CO)=______。
②下列说法正确的是______。
A.达到平衡时,![]() 的转化率为
的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氨气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应:
以体积比1:2置于密闭容器中发生反应:
![]() ,达到平衡时
,达到平衡时![]() 的体积分数为
的体积分数为![]() ,该反应的平衡常数
,该反应的平衡常数![]() ______。
______。
(3)碳与水蒸气反应制取![]() 的相关反应如下:
的相关反应如下:
Ⅰ![]()
Ⅱ![]()
Ⅲ![]()
①计算反应![]() 的
的![]() ______
______![]()
②对于可逆反应![]() ,采取以下措施可以提高
,采取以下措施可以提高![]() 产率的是______。
产率的是______。
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(4)以甲醇为燃料,![]() 为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]() 。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
(5)若往20mL![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
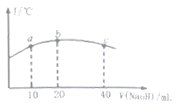
①该烧碱溶液的浓度为![]()
②该烧碱溶液的浓度为![]()
③![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
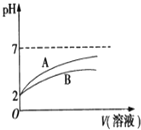
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(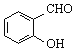 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com