
【题目】一定温度下,在某密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
科目:高中化学 来源: 题型:
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂采用稀NaOH溶液脱除![]() 。若碱洗脱除后所得废液的pH约为
。若碱洗脱除后所得废液的pH约为![]() 已知:相同温度下饱和
已知:相同温度下饱和![]() 溶液的pH约为
溶液的pH约为![]() ,则下列说法正确的是
,则下列说法正确的是
A.该溶液中:![]()
B.该溶液中:![]()
C.加水稀释该溶液,恢复至原温度,pH增大,![]() 不变
不变
D.该溶液pH约为13的原因:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+ 2KNO3+ 3C![]() 3CO2↑+ A + N2↑(已配平)
3CO2↑+ A + N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为__________。
②生成物A的晶体类型为__________,含极性共价键的分子的中心原子轨道杂化类型为_______。
③已知CN-与N2结构相似,推算HCN分子中![]() 键与
键与![]() 键数目之比为____________。
键数目之比为____________。
(2)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(3)下列有关说法正确的是______________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图

D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,试写出反应的离子方程式:_______。
(5)氮化硼形成立方晶体,晶体结构类似金刚石,如图所示。
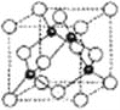
已知:该晶体密度为ρg·㎝-3,NA代表阿伏加德罗常数的值。
①该晶体的化学式为______________。
②在该晶体中,B与N形成共价键的键长(d)为________________________pm(列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
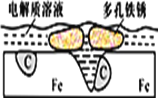
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置进行相应实验,有关说法不正确的是
A.图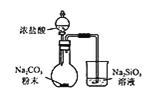 装置可验证酸性:
装置可验证酸性:![]()
B.图 装置可用于收集气体
装置可用于收集气体![]()
C.图![]() 装置可用于分离
装置可用于分离![]() 萃取碘水后的有机层和水层
萃取碘水后的有机层和水层
D.图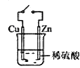 装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 和
和![]() 的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量
的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量![]() 与加入氢氧化钠溶液的体积
与加入氢氧化钠溶液的体积![]() 关系如图所示.则下列说法正确的是
关系如图所示.则下列说法正确的是

A.ab之间、c两点沉淀物成分相同,d、e两点沉淀物成分相同
B.在反应过程中,各状态点溶液的pH大小顺序是:![]()
C.![]() 段与
段与![]() 段溶液中阴离子的物质的量相等
段溶液中阴离子的物质的量相等
D.在d点,向溶液中逐滴加入盐酸,沉淀量将减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com