
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
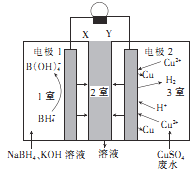
A.电极1为负极
B.Y为阳离子选择性交换膜
C.电极2上只有Cu析出
D.负极的电极反应式: ![]() +8
+8![]() 8
8![]() B
B![]() +4
+4![]()
【答案】BC
【解析】
由图中可知,1室中B![]() 转变为B
转变为B![]() 化合价身高发生氧化反应,则电极1为负极,电极方程式为:
化合价身高发生氧化反应,则电极1为负极,电极方程式为:![]() ,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:
,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:![]() ,
,![]() ,阳离子被消耗,为了平衡电荷阴离子流入2室,以此分析。
,阳离子被消耗,为了平衡电荷阴离子流入2室,以此分析。
由图中可知,1室中B![]() 转变为B
转变为B![]() 化合价身高发生氧化反应,则电极1为负极,电极方程式为:
化合价身高发生氧化反应,则电极1为负极,电极方程式为:![]() ,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:
,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:![]() ,
,![]() ,阳离子被消耗,为了平衡电荷阴离子流入2室,故X为阳离子交换膜,Y为阴离子交换膜。
,阳离子被消耗,为了平衡电荷阴离子流入2室,故X为阳离子交换膜,Y为阴离子交换膜。
A.电极1为负极,故A正确;
B. Y为阴离子选择性交换膜,故B错误;
C. 电极2上只有Cu、H2析出,故C错误;
D.负极的电极反应式:![]() ,故D正确;
,故D正确;
故答案选:BC。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
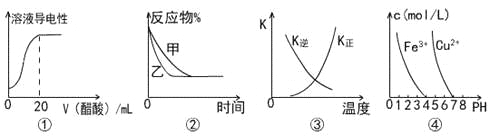
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
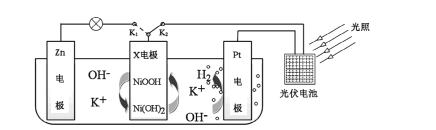
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为![]()
C.供电时,Zn电极附近溶液的pH降低
D.供电时,装置中的总反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑![]()
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
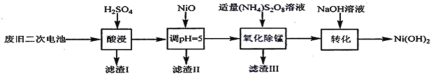
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?____________(列式计算,并使用必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是目前世界上产量最大的聚酯类合成纤维,冬奥会比赛场馆装饰材料、矿泉水瓶、磁带和胶卷的片基等都广泛采用PET材料。以卤代烃为原料合成PET的线路如下(反应中部分无机反应物及产物已省略)。已知RX2(R、R1代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%。
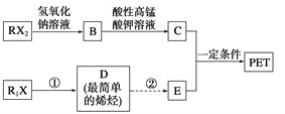
(1)RX2中苯环上有两个取代基,且苯环上的一硝基取代物只有一种。则RX2的结构简式为____________。
(2)1 mol C与足量碳酸氢钠溶液反应可放出________L CO2(标准状况下)。
(3)反应①的化学方程式为______________,其反应类型为________。从D到E,工业上一般通过两步反应来完成。若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式为________________。
(4)C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应;③与新制氢氧化铜悬浊液在加热条件下反应;④在稀硫酸中能发生水解反应。同时符合上述条件的M的结构有________种。
(5)写出合成PET的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收
B. 甲酸甲酯(HCOOCH3)和乙酸是同分异构体
C. 石油催化裂化的主要目的是提高芳香烃的产量
D. 聚丙烯的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某黄色固体的组成和性质,设计如下实验:

请回答:
(1)X 的化学式是_______。
(2)X 在空气中充分灼烧的化学方程式为_______。
(3)溶液 A 与烧碱反应生成 B 和浅黄色沉淀(0.01mol)的化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com