
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 N2O4 △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
N2O4 △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
A.气体的物质的量 B.压强 C.质量 D.密度
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的乙烯的方法是( )
A.通入足量溴水中 B.在空气中燃烧
C.通入酸性高锰酸钾溶液中 D.在一定条件下通入氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:


⑴反应②是 (填“吸热”或“放热”)反应。
 ⑵某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
⑵某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
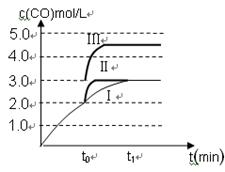
⑶在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
⑷甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是 。
⑸一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
C.升高温度, 减小 D.加入NaOH固体,溶液pH减小
减小 D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX HZ HY B.HX HY HZ
C.HZ HY HX D.HY HZ HX
查看答案和解析>>
科目:高中化学 来源: 题型:
800℃时,在2L密闭容器内,发生反应:2NO(g)+O2(g) 2NO2(g),已知在此体系中,n(NO)随时间的变化如表:
2NO2(g),已知在此体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
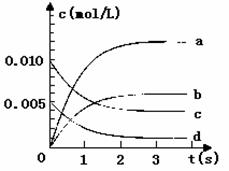
(1)已知升高温度,NO2的浓度减小,则该反应是 (填“吸”或“放”)热反应。
(2)该反应平衡常数K的表达式为 。
(3)右图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
(4)为使该反应的反应速率增大,且平衡向正反应
方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
将一小块金属钠投入足量的下列溶液中,既能生成气体,又能生成蓝色沉淀的是
A.CuSO4溶液 B.Ba(OH)2稀溶液
C.MgCl2溶液 D.CaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.将水加热,Kw增大,pH不变
B.燃烧热是指可燃物热化学反应方程式中的△H
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com