
| A、镁元素在元素周期表中位于第三周期、ⅡA族 | B、向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 | C、在氯化氢热气流中干燥晶体的目的是加快干燥速度 | D、步骤⑤也可以采用电解该晶体水溶液的方法 |
| 加入石灰乳 |
| 过滤洗涤沉淀物 |
| 加入盐酸、结晶、过滤 |
| 在HCl热气流中干燥 |
| 电解 |
| 加入石灰乳 |
| 过滤洗涤沉淀物 |
| 加入盐酸、结晶、过滤 |
| 在HCl热气流中干燥 |
| 电解 |


科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
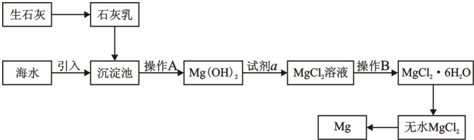
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是:(四) | ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
| ||
| 2800℃ |
| △ |
| ||
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| ||
| 还原 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
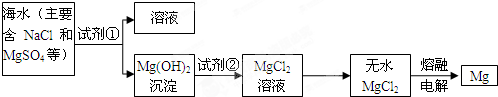
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com